











1 方法來源
FDA/BAM Chapter 9 Vibrio2004
2 適用範圍
本程序規定了食品中創傷弧菌(Vibrio vulnificus)的檢驗方法。本程序適用於食品中創傷弧菌的檢驗。
3 設備和材料
除微生物實驗室常規滅菌及培養設備外,其他設備和材料如下。
3.1 恒溫培養箱:36℃±1℃、39.5℃±0.5℃。
3.2 冰箱:2℃~5℃、7℃~10℃。
3.3 恒溫水浴箱:36℃±1℃。
3.4 均質器或無菌乳缽。
3.5 天平:感量0.1 g。
3.6 無菌試管:18 mm×180mm、15mm×100mm。
3.7 無菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)或微量移液器及吸頭。
3.8 無菌錐形瓶:容量250mL、500 mL、1000mL。
3.9 無菌培養皿:直徑90mm。
3.10 無菌手術剪、鑷子。
3.11 PCR儀。
3.12 電泳裝置。
3.13 凝膠分析成像係統。
3.14 PCR超淨工作台。
3.15 高速台式離心機(15000r/min)。
3.16 微量可調移液器(2μL、10μL、100μL、1000μL)和相應吸頭。
4 培養基和試劑
4.1 3%氯化鈉堿性蛋白腖水:見附錄A中A.1。
4.2 改良纖維二糖-多粘菌素B-多粘菌素E(mCPC)瓊脂:見附錄A中A.2。
4.3 纖維二糖-多粘菌素E(CC)瓊脂:見附錄A中A.3。
4.4 3%氯化鈉胰蛋白腖大豆瓊脂:見附錄A中A.4。
4.5 3%氯化鈉三糖鐵瓊脂:見附錄A中A.5。
4.6 嗜鹽性試驗培養基:見附錄A中A.6。
4.7 3%氯化鈉賴氨酸脫羧酶試驗培養基:見附錄A中A.7。
4.8 3%氯化鈉MR-VP培養基:見附錄A中A.8。
4.9 3%氯化鈉溶液:見附錄A中A.9。
4.10 氧化酶試劑:見附錄A中A.10。
4.11 革蘭氏染色液:見附錄A中A.11。
4.12 鄰硝基酚-β-D-半乳糖苷(ONPG)試劑:見附錄A中A.12。
4.13 Voges-Proskauer(V-P)試劑:見附錄A中A.13。
4.14 生化鑒定試劑盒。
4.15 DNA提取液。
4.16 6×上樣緩衝液。
4.17 0.5×TBE。
4.18 瓊脂糖。
4.19 DNA分子量標記物(100 bp-1000 bp)。
4.20 PCR反應配套試劑。
第一法 定性檢驗
5 檢驗程序
創傷弧菌檢驗程序見圖1。
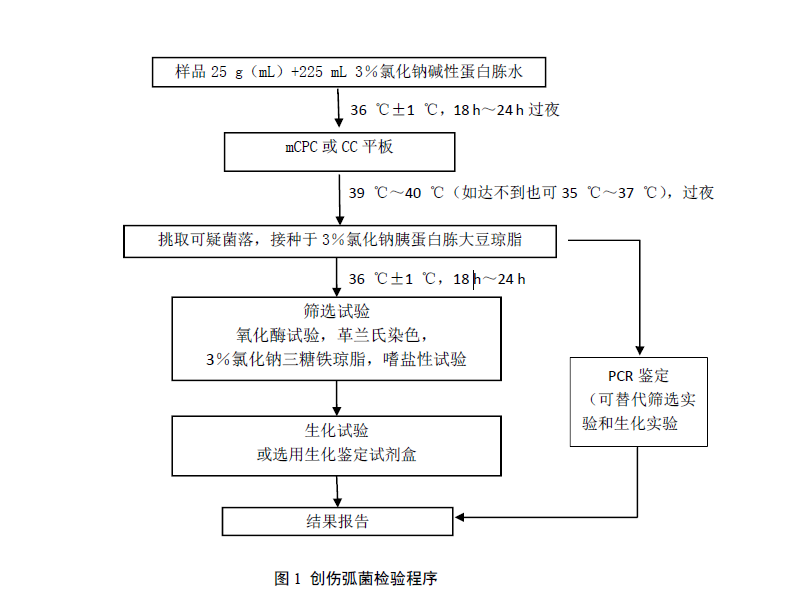
6 操作步驟
6.1 樣品製備
6.1.1 非冷凍樣品采集後應立即置7℃~10℃冰箱保存,盡可能及早檢驗;冷凍樣品應在45 ℃以下不超過15min或在2 ℃~5 ℃不超過18 h解凍。
6.1.2 魚類和頭足類動物取表麵組織、腸或鰓。貝類取全部內容物,包括貝肉和體液;甲殼類取整個動物,或者動物的中心部分,包括腸和鰓。如為帶殼貝類或甲殼類,則應先在自來水中洗刷外殼並甩幹表麵水分,然後以無菌操作打開外殼,按上述要求取相應部分。
6.1.3 以無菌操作取樣品25g(mL),加入3%氯化鈉堿性蛋白腖水225mL,用旋轉刀片式均質器以8000r/min~10000r/min均質1min~2min,或拍擊式均質器拍擊1min~2min,製備成1:10的樣品勻液。如無均質器,則將樣品放入無菌乳缽,自225mL3%氯化鈉堿性蛋白腖水中取少量稀釋液加入無菌乳缽,樣品磨碎後放入500mL無菌錐形瓶,再用少量稀釋液衝洗乳缽中的殘留樣品1~2次,洗液放入錐形瓶,最後將剩餘稀釋液全部放入錐形瓶,充分振蕩,製備1:10的樣品勻液。
6.2 增菌
將上述1:10樣品勻液於36℃±1℃培養18 h~24 h。
6.3 分離
6.3.1 對所有顯示生長的增菌液,用接種環在距離液麵以下1cm內沾取一環增菌液,於mCPC或CC平板上劃線分離。於39℃~40 ℃過夜培養(如果達不到39 ℃~40 ℃,則35 ℃~37 ℃)。
6.3.2 典型的創傷弧菌在mCPC和CC平板上呈現為圓的、扁平的、中心不透明邊緣透明的黃色菌落,直徑1 mm~2 mm。
6.4 純培養
挑取3個或以上可疑菌落,劃線接種3%氯化鈉胰蛋白腖大豆瓊脂平板,36℃±1℃培養18 h~24 h。
6.5 初步鑒定
6.5.1 氧化酶試驗:挑選純培養的單個菌落進行氧化酶試驗,創傷弧菌為氧化酶陽性。
6.5.2 塗片鏡檢:將可疑菌落塗片,進行革蘭氏染色,鏡檢觀察形態。創傷弧菌為革蘭氏陰性,呈棒狀、弧狀、卵圓狀等多形態,無芽胞,有鞭毛。
6.5.3 挑取純培養的單個可疑菌落,轉種3%氯化鈉三糖鐵瓊脂斜麵並穿刺底層,36℃±1℃培養24 h觀察結果。創傷弧菌在3%氯化鈉三糖鐵瓊脂中的反應為底層變黃不變黑,無氣泡,斜麵顏色不變或紅色加深,偶爾斜麵變黃。
6.5.4 嗜鹽性試驗:挑取純培養的單個可疑菌落,分別接種0%、6%、8%和10%不同氯化鈉濃度的胰腖水,36℃±1 ℃培養24 h,觀察液體混濁情況。創傷弧菌在無氯化鈉、8%氯化鈉和10%氯化鈉的胰腖水中不生長或微弱生長,在6%氯化鈉的胰腖水中生長旺盛。
6.6 確證鑒定
取純培養物分別接種含3%氯化鈉的賴氨酸脫羧酶試驗培養基、MR-VP培養基,36℃±1℃培養24 h~48 h後觀察結果;3%氯化鈉三糖鐵瓊脂隔夜培養物進行ONPG試驗。可選擇生化鑒定試劑盒。創傷弧菌的生化性狀見表1,創傷弧菌主要性狀與其他弧菌的鑒別見表2。
表1 創傷弧菌的生化性狀
|
試驗項目 |
結果 |
|
革蘭氏染色鏡檢 |
陰性,棒狀或弧狀 |
|
氧化酶 |
+ |
|
動力 |
+ |
|
D-纖維二糖 |
+ |
|
蔗糖 |
- |
|
葡萄糖 |
+ |
|
分解葡萄糖產氣 |
- |
|
乳糖 |
+ |
|
硫化氫 |
- |
|
賴氨酸脫羧酶 |
+ |
|
V-P |
- |
|
ONPG |
+ |
|
注:+陽性;-陰性。 |
|
表2 創傷弧菌主要性狀與其他弧菌的鑒別
|
名稱 |
氧 化 酶 |
賴 氨 酸 |
精 氨 酸 |
鳥 氨 酸 |
明 膠 |
脲 酶 |
V ︱ P |
42 ℃ 生 長 |
蔗 糖 |
D ︱ 纖 維 二 糖 |
乳 糖 |
阿 拉 伯 糖 |
D ︱ 甘 露 糖 |
D ︱ 甘 露 醇 |
ONPG |
嗜鹽性試驗 NaCl含量(%) |
||||
|
0 |
3 |
6 |
8 |
10 |
||||||||||||||||
|
創傷弧菌 |
+ |
+ |
- |
+ |
+ |
- |
- |
+ |
- |
+ |
+ |
- |
+ |
V |
+ |
- |
+ |
+ |
- |
- |
|
副溶血性弧菌 V. parahaemolyticus |
+ |
+ |
- |
+ |
+ |
V |
- |
+ |
- |
V |
- |
+ |
+ |
+ |
- |
- |
+ |
+ |
+ |
- |
|
溶藻弧菌 V. alginolyticus |
+ |
+ |
- |
+ |
+ |
- |
+ |
+ |
+ |
- |
- |
- |
+ |
+ |
- |
- |
+ |
+ |
+ |
+ |
|
霍亂弧菌 V.cholerae |
+ |
+ |
- |
+ |
+ |
- |
V |
+ |
+ |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
|
擬態弧菌 V.mimicus |
+ |
+ |
- |
+ |
+ |
- |
- |
+ |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
|
河弧菌 V. fluvialis |
+ |
- |
+ |
- |
+ |
- |
- |
V |
+ |
+ |
- |
+ |
+ |
+ |
+ |
- |
+ |
+ |
V |
- |
|
弗氏弧菌 V.furnissii |
+ |
- |
+ |
- |
+ |
- |
- |
- |
+ |
- |
- |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
- |
|
梅氏弧菌 V. metschnikovii |
- |
+ |
+ |
- |
+ |
- |
+ |
V |
+ |
- |
- |
- |
+ |
+ |
+ |
- |
+ |
+ |
V |
- |
|
霍利斯弧菌 V. hollisae |
+ |
- |
- |
- |
- |
- |
- |
nd |
- |
- |
- |
+ |
+ |
- |
- |
- |
+ |
+ |
- |
- |
|
嗜水氣單胞菌 A.hydrophilia |
+ |
V |
+ |
- |
+ |
- |
V |
V |
+ |
V |
V |
V |
+ |
+ |
+ |
+ |
+ |
+ |
- |
- |
|
類誌賀鄰單胞菌 |
+ |
+ |
+ |
+ |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
+ |
+ |
- |
- |
- |
| 注:nd 表示未試驗;V 表示可變。 | ||||||||||||||||||||
6.7 PCR鑒定(選做)
6.7.1 DNA模板的製備
取可疑的純菌落加入500 μL滅菌dH2O中混勻煮沸10 min,15000×g離心3 min。取上清液儲存在-20℃直至使用。也可以用商業化的DNA提取試劑盒並按其說明提取製備DNA模板。
6.7.2 PCR擴增
6.7.2.1 引物
|
Vvh-785F |
5' ccg cgg tac agg ttg gcg ca 3' |
|
Vvh-1303R |
5' cgc cac cca ctt tcg ggc c 3' |
擴增片段長度:519 bp
6.7.2.2 陰性對照、陽性對照設置
陰性對照(空白對照)以滅菌水作為PCR反應的模板;
陽性對照采用含有檢測序列的DNA(或質粒)作為PCR反應的模板。
6.7.2.3 PCR反應體係
|
試劑 |
反應體積 |
|
dH2O |
28.2 μL |
|
10× Buffer. MgCl2 |
5.0 μL |
|
dNTPs |
8.0 μL |
|
引物 |
7.5 μL |
|
模板 |
1.0 μL |
|
Taq酶 |
0.3 μL |
|
總體積 |
50.0 μL |
6.7.2.4 PCR反應程序
|
預變性 |
94℃ |
10 min; |
|
變性 |
94℃ |
1 min, |
|
退火 |
62℃ |
1 min, |
|
延伸 |
72℃ |
1 min,25個循環; |
|
終延伸 |
72℃ |
10 min; |
|
保存 |
8℃ |
—— |
6.7.2.5 電泳
用0.5×TBE製備1.5%的瓊脂糖凝膠(含EB或Goldview0.5μg /mL,)。各取5 μl PCR產物點樣(可包括適量上樣緩衝液),用DNA分子量標記物做參照,電壓100 V,電泳50 min(根據實驗室儀器情況確定具體電泳條件)。使用凝膠成像係統對電泳結果進行保存和分析。
6.8 結果判定
陰性對照未出現條帶,陽性對照出現預期大小的擴增條帶條件下,如待測樣品未出現519 bp大小的擴增條帶,則可判定該樣品檢驗結果為陰性;如待測樣品出現519 bp大小的擴增條帶,則可判定該樣品檢驗結果為陽性。
如果陰性對照出現條帶和/或陽性對照未出現預期大小的擴增條帶,本次待測樣品的結果無效,應重新進行試驗,並排除汙染因素。
6.9 報告
根據生化或PCR結果,報告25 g(mL)樣品中檢出或未檢出創傷弧菌。
第二法 MPN計數法
7 操作步驟
7.1 樣品製備
同6.1。
7.2 增菌
7.2.1 用滅菌吸管吸取1:10樣品勻液1 mL,注入含有9 mL 3%氯化鈉堿性蛋白腖水的試管內,振搖試管混勻,製備1:100的樣品勻液。
7.2.2 另取1 mL滅菌吸管,按6.2.2.1操作程序,依次製備10倍係列稀釋樣品勻液,每遞增稀釋一次,換用一支1 mL無菌吸管。
7.2.3 根據對檢樣汙染情況的估計,選擇3個適宜的連續稀釋度,每個稀釋度接種3支含有9mL3%氯化鈉堿性蛋白腖水的試管,每管接種1mL。置36℃±1℃恒溫箱內,培養18 h~24 h。
7.3 分離鑒定
同定性檢測。
8 結果與報告
根據證實為創傷弧菌陽性的試管管數,查最可能數(MPN)檢索表,報告每g(mL)創傷弧菌的MPN值。
上一篇:一次關於利用產氣莢膜梭菌進行2個國標檢測的方法證實過程及其收獲
下一篇:梭狀芽孢杆菌檢驗標準操作程序

