











1 方法來源
《食品及土壤中產肉毒毒素梭狀芽孢杆菌檢測實驗室操作流程》和《嬰兒食品、生物樣品及環境中梭狀芽孢杆菌檢測實驗室操作流程》
GB 4789.12-2016食品安全國家標準食品微生物學檢驗肉毒梭菌及肉毒毒素檢驗
2 適用範圍
本程序規定了食品中梭狀芽孢杆菌(Clostridium Prazmowski)的檢驗方法。本程序適用於食品中梭狀芽孢杆菌(Clostridium Prazmowski)的定性檢驗,包括丁酸梭菌(Clostridiumbutyricum)、產氣莢膜梭菌(Clostridiumperfringens)、艱難梭菌(Clostridiumdifficile)、生孢梭菌(Clostridiumsporogenes)、肉毒梭菌(Clostridiumbotulinum)、巴氏梭菌(Clostridiumbarati)等。
3 設備和材料
除微生物實驗室常規滅菌及培養設備外,其他設備和材料如下:
3.1 恒溫培養箱(4~50℃±1℃)。
3.2 厭氧裝置(厭氧罐、厭氧箱等)。
3.3 生物安全櫃。
3.4 比濁儀。
3.5 冰箱(0~4℃、-20℃及-80℃)。
3.6 離心機(0~20000rpm)。
3.7 樣品均質器。
3.8 渦旋器。
3.9 電泳儀。
3.10 PCR儀。
3.11 恒溫振蕩器。
3.12 電熱恒溫水浴箱(10℃~100℃)。
3.13 電子天平(精度0.01g及0.0001g)。
3.14 熒光PCR儀。
3.15 高壓滅菌鍋。
3.16 顯微鏡。
3.17 滅菌吸管。
3.18 PCR管。
3.19 無菌錐形瓶。
3.20 無菌培養皿:直徑90mm。
3.21 無菌離心管。
3.22 無菌試管。
3.23 載玻片。
3.24 酒精燈。
3.25 pH計或pH比色管或精密pH試紙。
4 培養基和試劑
4.1 明膠磷酸鹽緩衝液(GBS):見附錄A中A.1。
4.2 庖肉培養基(CMM):見附錄A中A.2。
4.3 胰蛋白酶胰蛋白腖葡萄糖酵母膏肉湯(TPGYT):見附錄A中A.3。
4.4 哥倫比亞血瓊脂培養基:見附錄A中A.4。
4.5 LB肉湯培養基。
4.6 LB瓊脂培養基。
4.7 pMD19-Tvectorcloningkit。
4.8 JM109感受態細胞。
4.9 2×PfuPCR MasterMix。
4.10 氨苄青黴素。
4.11 IPTG。
4.12 X-Gal。
4.13 膠回收試劑盒。
4.14 DNA提取試劑盒。
4.15 革蘭氏染液:見附錄A中A.5。
4.16 標準菌株:丁酸梭菌CICC10390生孢梭菌CICC10385。
5 定性檢驗
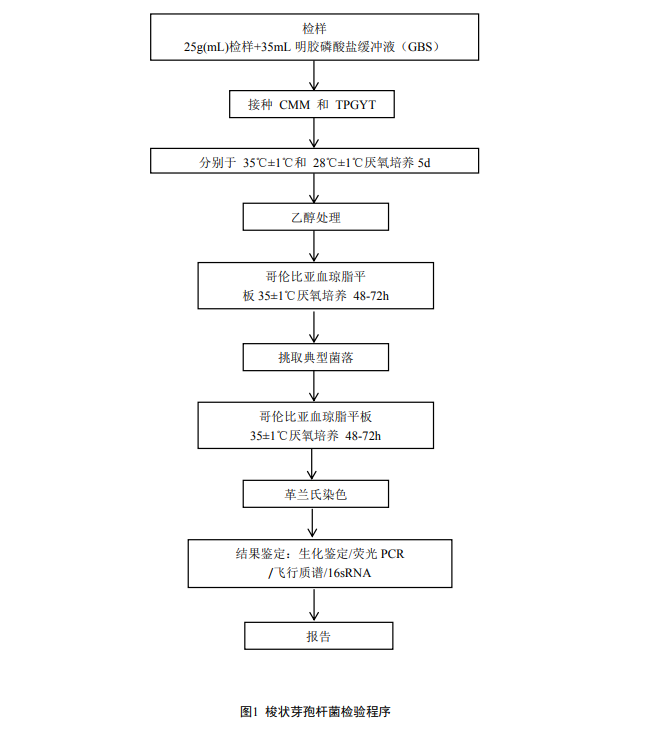
6 操作步驟
6.1 增菌培養
接種前,先將CMM和TPGY培養基沸水中隔水煮沸10min-15min後,迅速放入冰或冰水浴中快速冷卻。
取混勻後的食品樣品25g於無菌均質袋內,加入35mL明膠磷酸鹽緩衝液(1:1.5稀釋,緩衝液加入比例可根據具體樣品性狀進行適量增減,原則上加入的稀釋液體積越少越好),於勻漿器中充分混勻後,取2mL樣液分別接種CMM和TPGYT培養基,每種培養基接種2管。若為風幹樣品,則加入明膠磷酸鹽緩衝液室溫浸泡60min後再進行勻漿及接種。
6.2 培養物檢查
培養5天後,檢查培養物的濁度、產氣、肉粒消化及氣味。如果培養5天的增菌液中沒有細菌生長,則應繼續培養10天。
6.3 菌的分離
6.3.1 增菌液前處理
取1-2mL增菌液於5mL滅菌離心管內,加入等量的無水乙醇,充分混勻, 室溫靜置1h。用接種環取經無水乙醇處理後的增菌液接種至哥倫比亞血瓊脂平板內,35±1℃厭氧培養48-72h,培養期間嚴禁破壞厭氧環境。
6.3.2 典型菌落挑選
典型梭狀芽孢杆菌在哥倫比亞血瓊脂培養基上菌落多為白色或半透明,扁平、粗糙、蔓延根狀生長或輪狀生長,難刮除菌落;典型肉毒梭菌多為扁平圓形菌落,半透明,蔓延輪狀生長,邊緣整齊或不整齊,部分菌落可在短時間內蔓延長滿整個平板。在分離平板上選擇5個分離良好的典型菌落,分別再次接種哥倫比亞血瓊脂平板,35±1℃厭氧培養48-72h。
6.4 革蘭氏染色鏡檢
挑取純培養後的細菌菌落,塗片革蘭氏染色後鏡檢,觀察菌落形態,並注意是否有典型的梭狀菌、是否形成芽孢以及芽孢的位置等。同時對革蘭氏陽性的純培養物進行鑒定。
6.5 結果鑒定
6.5.1 生化鑒定
選擇微生物全自動生化鑒定係統,VITEK 2 ANC TEST KIT鑒定卡,按操作說明進行鑒定。因人工判讀誤差較大,正確率低,不推薦使用API20A或Crystal Anaerobe ID 等商品化試劑條鑒定。
6.5.2 熒光PCR檢測
表1 梭菌屬鑒定用引物和探針序列
|
引物和探針 |
序列(5’- 3’) |
|
上遊引物 |
GCTCGTGTCGTGAGATGTT |
|
下遊引物 |
CTCRYTAGAGTSCTCAACYWAA |
|
探針 |
FAM- AAYAAYAAGGGTTGCGCTCGTTGC- BQ1 |
|
注:所有引物和探針均配置成10%μmol/L 濃度後使用。 |
|
6.5.2.1 挑取革蘭氏染色呈陽性梭狀芽孢杆菌的二次傳代純培養後的新鮮菌落約20個,懸浮於1mL滅菌蒸餾水內,100℃煮沸10min後置於冰或冰水浴中迅速冷卻,10000r/min離心2min 後備用。
6.5.2.2 每個反應的總體積為25μl,體係組分為:Probemastermix12.5μl,上遊引物和下遊引物各0.8μl,探針0.5μl,去除DNA酶和RNA酶的無菌水5.4μl,模板DNA5μl。反應條件:95℃10min,1個循環;95℃20s,60℃30s,72℃30s,45個循環。
6.5.2.3 判定標準:當空白對照Ct≥40,陰性對照Ct≥40,陽性對照Ct<35,滿足以上條件者檢測結果 方有效。若樣品Ct<35,則判定樣品中含有梭狀芽孢杆菌屬;若樣品Ct≥40,則判定樣品中不含梭狀芽孢杆菌屬;若35≤Ct<40,需對樣品進行重複實驗,如重複結果仍然為35≤Ct<40,則判定樣品中不含有梭狀芽孢杆菌屬。
6.5.2.4 熒光PCR檢測鑒定梭菌屬陽性的菌株繼續采用其它鑒定手段進一步鑒定到種,也可用商品化良潤梭菌菌種鑒定試劑盒(PCR-探針法)進行梭狀芽胞杆菌熒光PCR 鑒定。
6.5.3 微生物飛行時間質譜檢測
運用飛行時間質譜對革蘭氏染色陽性的純培養物進行鑒定。注:飛行時間質譜無法對肉毒梭菌進行鑒定
6.5.4 16sRNA測序
6.5.4.1 細菌DNA提取
按照革蘭氏陽性菌DNA試劑盒要求提取DNA。
6.5.4.2 基因擴增
通用引物對細菌16S RNA進行PCR擴增,陽性菌株電泳後按照膠回收試劑盒要求切膠回收。實驗應設陰性及空白對照。引物及PCR擴增條件分離見表2、表3、表4。
表2 16 SRNA PCR反應引物序列
|
引物名稱 |
引物序列 |
片段大小/bp |
|
FD1 |
5’-AGA GTT TGA TCC TGG CTC AG -3’ |
1500bp |
|
RP2 |
5’-ACG GCT ACC TTG TTA CGA CTT-3’ |
表3 16 SRNA PCR反應體係
|
試劑 |
終濃度 |
加入體積/μL |
|
2×Pfu PCR MasterMix |
|
25.0 |
|
10μmol/L 正向引物 |
0.2μmol/L |
1.0 |
|
10μmol/L 反向引物 |
0.2μmol/L |
1.0 |
|
DNA 模板 |
|
1.0 |
|
ddH2O |
|
22.0 |
|
總體積 |
|
50.0 |
表4 16 SRNA PCR反應條件
|
預變性 |
擴增 |
循環數 |
延伸 |
|
95℃ 5min |
95℃,30s |
30 |
72℃,8min |
|
|
55℃,30s |
|
|
|
|
72℃,2min |
6.5.4.3 16SRNAPCR產物克隆
6.5.4.3.1 PCR產物與質粒連接:按照表5加入各反應物,16℃反應30分鍾以上。
表5 PCR產物連接
|
試劑 |
加入量 |
|
pMD19-T vector |
1μL |
|
DNA 模板 |
2μL |
|
ddH2O |
2μL |
|
Solution I |
5μL |
|
總體積 |
10μL |
6.5.4.3.2 連接產物的轉化
全量(10μL)加入至100μL JM109感受態細胞中,冰中放置30分鍾。42℃加熱45秒鍾後,再在冰中放置1分鍾。加入890μL SOC培養基,36±1℃振蕩培養60分鍾。
6.5.4.3.3 克隆產物篩選:
在含100μg/mL氨苄西林的LB瓊脂培養基平皿上加入24mg/mL的IPTG 25μL,20mg/mL的X-Gal 50μL,無菌塗布均勻後避光保存備用。取6.6.3.2製備好的菌液100μL的菌液塗布於處理後的LB瓊脂培養基平皿上,36±1℃避光培養16-18h後,挑取瓊脂平板上的白色菌落接種於含有氨苄西林的LB肉湯,36±1℃振蕩培養6h。
6.5.4.3.4 克隆產物PCR 確認
引物及PCR擴增條件見表6、表7及表8,其中反應總體積可根據實際需要進行調整。實驗應設陰性及空白對照。
表6 PCR反應的引物序列
|
引物名稱 |
引物序列 |
片段大小/bp |
|
M13
RV |
5’-GAGCGGATAACAATTTCACACAGG-3’
5’-CGCCAGGGTTTTCCCAGTCACGAC-3’ |
1500bp |
表7 PCR反應體係
|
試劑 |
終濃度 |
加入體積/μL |
|
|
10×PCR緩衝液 |
1× |
5.0 |
|
|
25mmol/L MgCl2 |
2.5mmol/L |
5.0 |
|
|
10μmol/L dNTPs |
0.2mmol/L |
1.0 |
|
|
10μmol/L正向引物 |
0.2μmol/L |
1.0 |
|
|
10μmol/L反向引物 |
0.05U/μL |
1.0 |
|
|
5U/mL Taq 酶 |
|
0.5 |
|
|
DNA 模板 |
|
1.0 |
|
|
ddH2O |
|
35.5 |
|
|
總體積 |
|
50 |
|
表8 PCR反應條件
|
預變性 |
擴增 |
循環數 |
延伸 |
|
95℃,5min |
95℃,1min |
30 |
72℃,8min |
|
|
55℃,1min |
|
|
|
|
72℃,1.5min |
6.5.4.4 將經PCR確認克隆成功菌株進行測序,並比對基因序列。
注:16sRNA克隆測序結果不能將生孢梭菌和肉毒梭菌進行準確區分,因為生孢梭菌和A型、B型肉毒梭菌16sRNA序列有99%以上同源。
6.5.5 肉毒梭菌鑒定
疑似為肉毒梭菌的菌株需要需要檢測毒素基因或進行動物實驗確認。
6.5.5.1 肉毒毒素基因PCR檢測
6.5.5.1.1細菌DNA提取:按照革蘭氏陽性菌DNA試劑盒要求提取DNA。
6.5.5.1.2 基因擴增:采用針對A、B、E、F型肉毒梭菌肉毒毒素基因設計的通用引物進行PCR擴增。引物及PCR反應體係和參數見表8、表9和表10。反應體係中各試劑的量可根據具體情況或不同的反應總體積進行適當的調整。PCR檢測時反應體係應設置陽性對照、陰性對照和空白對照。
表9 肉毒毒素基因PCR檢測的引物序列
|
毒素類型 |
引物名稱 |
引物序列 |
片段大小/bp |
|
A型 |
F |
5' -GTG ATA CAA CCA GAT GGT AGT TAT AG -3' |
983 |
|
|
R |
5' -AAA AAA CAA GTC CCA ATT ATT AAC TTT -3' |
|
|
B型 |
F |
5' -GAG ATG TTT GTG AAT ATT ATG ATC CAG -3' |
492 |
|
|
R |
5'-GTT CAT GCA TTA ATA TCAAGG CTG G -3' |
|
|
E型 |
F |
5'-CCA GGC GGT TGT CAA GAA TTT TAT -3' |
410 |
|
|
R |
5'-TCA AAT AAA TCA GGC TCT GCT CCC -3' |
|
|
F型 |
F |
5'-GCT TCA TTA AAG AAC GGA AGC AGT GCT-3' |
1137 |
|
|
R |
5'-GTG GCG CCT TTG TAC CTT TTC TAG G -3' |
|
表10 肉毒毒素基因PCR檢測的反應體係
|
試劑 |
終濃度 |
加入體積/μL |
|
|
10xPCR緩衝液 |
1x |
5.0 |
|
|
25mmol/L MgCl2 |
2.5mmol/L |
5.0 |
|
|
10μmol/L dNTPs |
0.2mmol/L |
1.0 |
|
|
10μmol/L正向引物 |
0.5μmol/L |
2.5 |
|
|
10μmol/L反向引物 |
0.5μmol/L |
2.5 |
|
|
5U/mLTaq酶 |
0.05U/μL |
0.5 |
|
|
DNA模板 |
|
1.0 |
|
|
ddH2O |
|
32.5 |
|
|
總體積 |
|
50 |
|
表11 肉毒毒素基因PCR檢測的反應參數
|
預變性 |
擴增 |
循環數 |
延伸 |
|
95℃,5min |
95℃,1min 45℃,1min 72℃,5min |
35 |
72℃,10min |
6.5.5.1.3 結果分析:電泳檢測結果用凝膠成像係統記錄。陰性對照和空白對照均未出現條帶,陽性對照出現預期大小的擴增條帶,待測樣品出現預期大小的擴增條帶,判定為PCR結果陽性;待測樣品未出現預期大小的擴增條帶,判定PCR結果為陰性。實驗中設置的陰性對照、空白對照和陽性對照PCR檢測結果應符合上述情況。否則,任一種對照如果出現非上述正常結果,應重做實驗。 也可用商品化良潤梭菌菌種鑒定試劑盒(PCR-探針法)進行肉毒梭菌熒光 PCR鑒定。
6.5.5.2 動物實驗
按照GB4789.12-2016國標方法進行肉毒毒素檢測鑒定肉毒梭菌。
7 菌株保存
短期(1個月)保存:可保存於CMM肉湯培養基內。取純化後的菌落接種於CMM肉湯培養基內,於35±1℃厭氧培養48h-72h,待CMM肉湯培養基出現肉眼可見混濁後,於2-4℃冰箱保存。
中長期(1-2年)保存:可保存於磁珠保存管內。取純化後的菌落接種於哥倫比亞血平板培養基內,於35±1℃厭氧培養48h-72h,用無菌棉簽刮取適量菌落於磁珠管內混勻,吸除多餘液體,於-80℃冰箱保存。為保證菌株的高存活率,建議使用進口磁珠。
長期(2-10年)保存:將菌株冷凍幹燥後冷藏保存。取純化後的菌落接種於哥倫比亞血平板培養基內,於35±1℃厭氧培養48h-72h後,向每個平板中加入1mL脫脂奶粉配成的凍存液,用L塗布棒刮取平板上菌落於凍存液內,繼而吸取200uL放入凍幹瓶內,凍幹後於2-4℃冰箱保存。
8 結果與報告
8.1結果判定:依據6.5.1、6.5.2,6.5.3,6.5.4對梭狀芽孢杆菌進行判定。
8.2結果報告:在25g(mL)樣品中檢出或未檢出梭狀芽孢杆菌。
9 注意事項
9.1 樣品稀釋:用明膠磷酸鹽緩衝液稀釋樣品時,原則上稀釋到適宜於接種即可。
9.2 由於牛肉粒會吸收部分水分,為了獲取更多的增菌培養液,庖肉培養基製備時牛肉粒不宜放入過多。
9.3 隔水煮沸增菌培養基時,應在試管內的培養基沸騰後開始計時10-15min。向含有增菌液的試管內接種樣品時,盡量靠近試管底部接種,並避免接入氣泡和攪動。
9.4 為便於培養期間觀察,建議盡量用透明厭氧裝置培養,培養期間嚴禁打開厭氧裝置破壞厭氧環境。
9.5 為了檢驗培養環境的厭氧情況,培養過程中應在厭氧裝置中放入厭氧指示劑。
9.6 增菌過程中加入液體石蠟是為了保證提供充分的厭氧環境,若培養過程中使用的厭氧裝置密閉性好也可以不加液體石蠟封閉。取增菌液劃平板時應小心用移液器慢慢吸出增菌液於另一容器內再劃線,並盡可能去除液體石蠟,不推薦使用接種環直接從用液體石蠟封閉的增菌液中取樣直接劃平板。
上一篇:創傷弧菌檢驗標準操作程序

