











1 方法來源
1.1 進出口食品中霍亂弧菌檢測方法(SN/T 1022-2010)
1.2 衛生部《霍亂防治手冊》第六版(2013年)
2 適用範圍
本程序規定了食品中霍亂弧菌(Vibrio cholera)的檢驗方法。本程序適用於食品中霍亂弧菌的檢驗。
3 設備和材料
除微生物實驗室常規滅菌及培養設備外,其他設備和材料如下:
3.1 恒溫培養箱:36℃±1 ℃。
3.2 恒溫培養箱:41.5℃±1℃。
3.3 冰箱:2℃~5℃。
3.4 恒溫水浴箱:36℃±1℃。
3.5 均質器或無菌乳缽。
3.6 天平:感量0.1 g。
3.7 無菌試管:18 mm×180mm、15mm×100mm。
3.8 無菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)或微量移液器及吸頭。
3.9 無菌錐形瓶:容量250mL、500 mL、1000mL。
3.10 無菌培養皿:直徑90mm。
3.11 微生物生化鑒定係統。
3.12 無菌手術剪、鑷子。
4 培養基和試劑
4.1 堿性蛋白腖水:見附錄A中A.1。
4.2 硫代硫酸鹽-檸檬酸鹽-膽鹽-蔗糖(TCBS)瓊脂:見附錄A中A.2。
4.3 4號瓊脂:見附錄A中A.3。
4.4 慶大黴素瓊脂:見附錄A中A.4。
4.5 商品化生化鑒定試劑:見附錄A中A.5。
5 檢驗程序
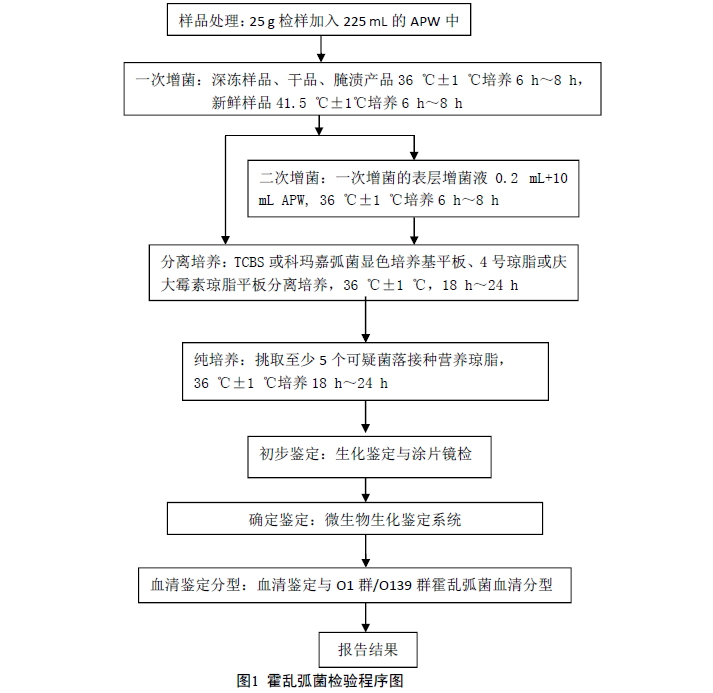
6. 操作步驟
6.1 樣品處理
稱取25g樣品放入盛有225mL堿性蛋白腖水的無菌均質杯中,以8000r/min~10000r/min均質1min~2min,或置於盛有225mL堿性蛋白腖水的無菌均質袋中,用拍擊式均質器拍打1min~2min。如無均質器,則將樣品放入無菌乳缽中磨碎,然後放在500mL的滅菌容器內,加225mL堿性蛋白腖水,並充分振蕩。
如為冷凍產品,應在45℃以下不超過15 min,或2 ℃~5℃不超過18h解凍。
6.2 一次增菌
將深凍樣品、幹品、醃漬產品於36℃±1℃培養6h~8h,新鮮樣品41.5℃±1℃培養6h~8h(如無明顯的細菌生長現象則繼續培養,但不能超過20 h)。
6.3 二次增菌
同時吸取上述一次增菌的表層增菌液0.2mL,加入10mL堿性蛋白腖水管中,36℃±1℃培養6 h~8 h。
6.4 分離
6.4.1 在所有顯示生長的一、二次增菌管中用接種環沾取一環表層增菌液,分別於TCBS(或科瑪嘉弧菌顯色培養基)平板、4號瓊脂(或慶大黴素瓊脂)平板上劃線分離。於36℃±1℃培養18 h~24 h。
6.4.2 各種平板上霍亂弧菌的典型菌落特征見表1。
表1 霍亂弧菌在不同選擇性瓊脂平板上的菌落特征
|
選擇性瓊脂平板 |
霍亂弧菌 |
|
TCBS |
圓形、邊緣半透明而中央不透明、表麵光滑的黃色菌落,直徑約3 mm左右。 |
|
科瑪嘉弧菌顯色培養基 |
藍色,藍綠色到綠色菌落。 |
|
4號瓊脂培養基 |
圓形、半透明、光滑濕潤、灰黑色水滴樣菌落,直徑約3 mm左右。 |
|
慶大黴素瓊脂平板 |
略帶青灰色、半透明、扁平、微隆起、光滑濕潤。如延長培養時間或室溫放置到48h, 菌落略帶黃色,中心形成黑色金屬碲沉澱。 |
6.4.3 純培養
每個平板上各挑取5個或以上可疑菌落(少於5個全部挑取),接種於營養瓊脂斜麵(或平板),36℃±1℃培養18h~24h。
6.5 初步鑒定
6.5.1 氧化酶試驗
挑選純培養的單個菌落進行氧化酶試驗,霍亂弧菌為陽性。
6.5.2 粘絲試驗
挑選純培養的單個菌落進行粘絲試驗,霍亂弧菌為陽性。
6.5.3 塗片鏡檢
將可疑菌落塗片,進行革蘭氏染色,鏡檢觀察形態。霍亂弧菌為革蘭氏陰性,呈弧形、逗點狀等多形態,無芽胞。
6.5.4 挑取純培養的單個可疑菌落,轉種三糖鐵瓊脂斜麵並穿刺底層,36℃
±1℃培養24 h觀察結果。霍亂弧菌在三糖鐵瓊脂中的反應為底層變黃不變黑,無氣泡,斜麵顏色變黃。
6.6 確定鑒定
初步鑒定結果相符者用微生物生化鑒定係統或商品化生化鑒定試劑進行係統鑒定。
6.7 血清鑒定分型
6.7.1 血清鑒定
自營養瓊脂斜麵上挑取純培養物與O1群及O139群霍亂弧菌診斷血清做玻片凝集試驗。玻片凝集用血清的效價一般應為1:40~1:50。如可疑菌落在血清中很快(一般在10 s內)出現肉眼可見的明顯凝集,在生理鹽水中不凝集者判為陽性。均不凝集方可報告未檢出O1群及O139群霍亂弧菌。
6.7.2 O1群霍亂弧菌血清分型
上述確定為O1群霍亂弧菌的培養物,分別使用小川型及稻葉型單價血清做玻片凝集,同時做生理鹽水對照。
6.8 報告
當檢出的可疑菌落生化學性狀符合表1要求,同時與霍亂弧菌診斷血清凝集(生理鹽水不凝集),報告25g(mL)樣品中檢出霍亂弧菌。霍亂弧菌主要性狀與其他弧菌的鑒別見表2。
表1 霍亂弧菌的生化性狀
|
試驗項目 |
結果 |
|
革蘭氏染色鏡檢 |
陰性,無芽胞 |
|
氧化酶 |
+ |
|
粘絲試驗 |
+ |
|
動力 |
+ |
|
蔗糖 |
+ |
|
葡萄糖 |
+ |
|
分解葡萄糖產氣 |
- |
|
乳糖 |
-/+ |
|
硫化氫 |
- |
|
注:+陽性;-陰性 |
|
表2 霍亂弧菌主要性狀與其他弧菌的鑒別
|
名稱 |
氧 化 酶 |
賴 氨 酸 |
精 氨 酸 |
鳥 氨 酸 |
明 膠 |
脲 酶 |
V ︱ P |
42 ℃ 生 長 |
蔗 糖 |
D ︱ 纖 維 二 糖 |
乳糖 |
阿 拉 伯 糖 |
D ︱ 甘 露 糖 |
D ︱ 甘 露 醇 |
O N P G |
嗜鹽性試驗NaCl含量(%) |
||||
|
0 |
3 |
6 |
8 |
1 0 |
||||||||||||||||
|
副溶血性弧菌 |
+ |
+ |
- |
+ |
+ |
V |
- |
+ |
- |
V |
- |
+ |
+ |
+ |
- |
- |
+ |
+ |
+ |
- |
|
創傷弧菌 |
+ |
+ |
- |
+ |
+ |
- |
- |
+ |
- |
+ |
+ |
- |
+ |
V |
+ |
- |
+ |
+ |
- |
- |
|
溶藻弧菌 |
+ |
+ |
- |
+ |
+ |
- |
+ |
+ |
+ |
- |
- |
- |
+ |
+ |
- |
- |
+ |
+ |
+ |
+ |
|
霍亂弧菌 |
+ |
+ |
- |
+ |
+ |
- |
V |
+ |
+ |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
|
擬態弧菌 |
+ |
+ |
- |
+ |
+ |
- |
- |
+ |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
|
河弧菌 |
+ |
- |
+ |
- |
+ |
- |
- |
V |
+ |
+ |
- |
+ |
+ |
+ |
+ |
- |
+ |
+ |
V |
- |
|
弗氏弧菌 |
+ |
- |
+ |
- |
+ |
- |
- |
- |
+ |
- |
- |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
- |
|
梅氏弧菌 |
- |
+ |
+ |
- |
+ |
- |
+ |
V |
+ |
- |
- |
- |
+ |
+ |
+ |
- |
+ |
+ |
V |
- |
|
霍利斯弧菌 |
+ |
- |
- |
- |
- |
- |
- |
nd |
- |
- |
- |
+ |
+ |
- |
- |
- |
+ |
+ |
- |
- |
|
注:nd表示未試驗;V表示可變。 |
||||||||||||||||||||
7. 毒力基因檢測
如鑒定結果為霍亂弧菌,需進行ctxAB基因的檢測。注意:也可采用經過驗證的商品化試劑盒。
7.1 DNA模板的製備
取適量純培養菌落加入500μL滅菌dH2O中混勻,煮沸10min,15000×g離心3 min。取上清液儲存在-20℃直至使用。也可以用商業化的DNA提取試劑盒,按其說明提取製備DNA模板。
7.2 PCR擴增
7.2.1 引物
可使用引物對5'-ATT TTG AGG TGT TCC ATG TG-3'和5'-ATA AAGCAGTCA GGT GGT CT-3'。擴增產物全長749bp。
7.2.2 陰、陽性對照設置
陰性對照(空白對照)以滅菌水作為PCR反應的模板;
陽性對照采用含有檢測序列的DNA(或質粒)作為PCR反應的模板。
7.2.3 PCR擴增反應體係
|
試劑 |
反應體積 |
|
dH2O |
12.8 μL |
|
10× Buffer. MgCl2 |
2.0 μL |
|
dNTPs |
0.8 μL |
|
混合引物 |
2.0 μL |
|
模板 |
2.0 μL |
|
Taq 酶 |
0.4 μL |
|
總體積 |
i. μ |
|
|
L |
|
預變性 |
94℃ |
5 min; |
|
變性 |
94℃ |
30 sec, |
|
退火 |
56℃ |
40 sec, |
|
延伸 |
72℃ |
2 min,30個循環; |
|
終延伸 |
72℃ |
7 min; |
|
保存 |
8℃ |
—— |
7.2.5 電泳
用0.5.5c序製備1.5%的瓊脂糖凝膠(含EB或Goldview 0.5μg /mL)。取5μL產物點樣(可包括適量上樣緩衝液),用DNA分子量標記物做參照,電壓100 V,電泳50 min(根據實驗室儀器情況確定具體電泳條件)。使用凝膠成像係統對電泳結果進行保存和分析。
7.3 結果判定
陰性對照未出現條帶,陽性對照出現預期大小的擴增條帶條件下,如待測樣品出現749 bp大小的擴增條帶,則可判定該菌株攜帶ctxAB基因;未出現749bp大小的擴增條帶,則可判定不攜帶ctxAB基因。
如果陰性對照出現條帶和/或陽性對照未出現預期大小的擴增條帶,本次待測樣品的結果無效,應重新進行試驗,並排除汙染因素。
上一篇:彎曲菌檢驗標準操作程序

