











一、參考標準
《GB5413.14-2010食品安全國家標準 嬰幼兒食品和乳品中維生素B12的測定》
二、方法原理
利用萊士曼氏乳酸杆菌(Lactobacillus leichmannii)對維生素B12的特異性和靈敏性,定量測定出試樣中維生素B12的含量。
在測定用培養基中供給除維生素B12以外的所有營養成分,這樣萊士曼乳杆菌生長濃度(吸光度)就會同標準曲線工作液及未知待測溶液中維生素B12的含量呈正比的線性關係。以不同濃度標準溶液的維生素B12含量為橫軸,以萊士曼乳杆菌生長濃度(吸光度)為縱軸,即可繪製標準曲線,根據標準曲線即可計算出試樣中維生素B12的含量。
三、試驗用品及預處理
(1)培養基:維生素B12測定用培養基;
(2)磷酸氫二鈉、無水偏重亞硫酸鈉、檸檬酸、生理鹽水、25%乙醇、純化水等;
(3)容器:試管、移液管、容量瓶、量筒、玻璃棒、錐形瓶。
注意事項:
①本方法所用試劑均為分析純試劑,水為GB/T 6682規定的二級水。水的潔淨程度對本試驗至關重要,若水中有維生素B12殘留或接觸了有維生素B12殘留的容器,將直接影響到試驗結果。
②試驗中使用的玻璃器具需洗淨後在200℃烘至少2h,必要時可預先用1mol/L的稀鹽酸浸泡再烘,充分去除容器中可能殘留的維生素B12。
③使用的維生素B12測定培養基需確保不含有維生素B12,其他營養齊全。若自行配製培養基,需確保原材料中不含有維生素B12,製備過程不可汙染維生素B12。
四、標準溶液的製備
(1)維生素B12貯備液(10μg/mL):精確稱取維生素B12標準品,用25%乙醇溶液定容至維生素B12濃度為10μg/mL。
(2)維生素B12中間液(100ng/mL):用25%乙醇溶液將5.0mL維生素B12貯備液定容至500mL。
(3)維生素B12工作液(1ng/mL):用25%乙醇溶液將5.0mL維生素B12中間液定容至500mL。
(4)標準曲線工作液:分別吸取兩個5mL維生素B12工作液於250mL和500mL容量瓶中,用水定容至刻度。高濃度溶液的濃度為0.02ng/mL;低濃度溶液的濃度為0.01ng/mL。
注意事項:
①標準溶液配製過程中使用的溶劑、容器必須確保無維生素B12殘留。
②所有標準溶液要儲存於冰箱內。維生素B12貯備液、中間液、工作液可保存三個月,標準曲線工作液臨用前配製。
五、菌株活化及菌懸液製備
(1)將萊士曼氏乳酸杆菌(ATCC 7830)菌株活化後,接種到乳酸杆菌瓊脂培養基上,36±1℃培養24h。再轉種2代~3代來增強活力。置2~5℃冰箱保存備用。每15d轉種一次。
(2)將活化後的菌株接種到乳酸杆菌肉湯培養基中,36±1℃培養18h~24h,以2000轉/分鍾離心2~3min,棄去上清液,加入10mL生理鹽水,振蕩懸浮混勻,再離心2~3min,棄去上清液,再加入10mL生理鹽水,振蕩懸浮混勻。再離心,棄去上清液。再加10mL生理鹽水,振蕩懸浮混勻。吸適量該菌懸液於10mL生理鹽水中,混勻製成透光率為60%-80%的測試菌液(以生理鹽水做空白,用分光光度計測550nm波長下的透光率)。
注意事項:
①萊士曼乳杆菌初次複蘇時活力較差,生長緩慢,必須連續轉接傳代2-3代或更多代數至菌株活力旺盛,方可用於試驗。
②萊士曼乳杆菌可連續傳代數十次仍然保持菌株特性穩定,可在傳代5次之後繼續使用(多數標準都規定傳代次數一般不可超過5代,而萊士曼乳杆菌可以多次傳代)。
③製備菌株過程需注意嚴格進行無菌操作,防止汙染雜菌。
④製備菌懸液過程中的重複離心-去上清-生理鹽水懸浮步驟目的為洗去活化培養基中的維生素殘留,不可省略或減少清洗次數,若清洗不幹淨,可能會對試驗結果造成不良影響。
六、樣品處理
(1)稱取無水磷酸氫二鈉1.3g,無水偏重亞硫酸鈉1.0g,檸檬酸(含一個結晶水)1.2g,用100mL水溶解。
(2)稱一定量的樣品 (精確到0.0001g),含維生素B12約50-100ng,用10mL的上述溶液混合後,再加150mL水,於121℃水解10min,冷卻後調pH至4.5±0.2,再用水定容至250mL,過濾。移取濾液5mL,加入水20~30mL,調pH至6.8±0.2,用水定容至100mL。最終溶液中維生素B12的質量濃度約在0.01 ng/mL~0.02ng/mL,偏重亞硫酸鈉的質量濃度小於0.03mg/mL。
七、試驗步驟
(1)標準曲線製作:按下表順序加入水、標準曲線工作液和維生素B12測定用培養基於試管中,做3個平行組。
|
試管 |
S1 |
S2 |
S3 |
S4 |
S5 |
S6 |
S7 |
S8 |
S9 |
S10 |
|
水(mL) |
5 |
5 |
4 |
3 |
2 |
1 |
0 |
2 |
1 |
0 |
|
0.01ng/mL標準曲線工作液(mL) |
0 |
0 |
1 |
2 |
3 |
4 |
5 |
0 |
0 |
0 |
|
0.02ng/mL標準曲線工作液(mL) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
3 |
4 |
5 |
|
培養基(mL) |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
(2)待測液的製作:按下表順序加入水、樣品溶液和維生素B12測定培養基於試管中,做3個平行組。
|
試管 |
1 |
2 |
3 |
4 |
|
水(mL) |
4 |
3 |
2 |
1 |
|
待測液(mL) |
1 |
2 |
3 |
4 |
|
培養基(mL) |
5 |
5 |
5 |
5 |
(3)滅菌:將所有試管置於121℃滅菌5min,滅菌結束後,迅速冷卻至30℃以下。
注意事項:不可滅菌時間過長或長時間在滅菌鍋中保溫,防止培養基中維生素成分過量降解;滅菌後的培養基宜當天使用。
(4)接種:用滴管或移液器向上述試管中各滴加1滴(約50μL)測試菌液(其中標準曲線管中空白S1除外)。
(5)培養:將試管放入恒溫培養箱內,36±1℃培養19h~20h。
(6)觀察:培養結束後,對每支試管進行目測檢查,未接種試管S1內培養液應是澄清的,如果出現渾濁,則測定無效。以接種空白管做對照,測定最高濃度標準曲線試管的透光率,2h後重新測定。兩次結果透光率差值若小於2%,則取出全部檢驗管測其透光率。
注意事項:若S1試管出現渾濁,可能是滅菌不徹底出現了汙染;若S2出現明顯渾濁,可能是培養基中有維生素B12汙染或接種的菌液汙染雜菌;兩次測定最高濃度標準曲線的透光率差值若<2%,說明細菌生長已達峰值,可進行測定,反之則需繼續培養至最高濃度,方可取出進行測定。
(7)測定:用未接種試管(S1)作空白,將分光光度計透光率調到100%(或吸光度為0),讀出接種空白試管(S2)的讀數。再以接種空白試管(S2)為空白,調節透光率為100%(或吸光度為 0),依次讀出其他每支試管的透光率(或吸光度)。
用渦旋混合器充分混合每一支試管(也可以加一滴消泡劑)後,立即將培養液移入比色皿內進行測定,波長為550nm,待讀數穩定30s後,讀出透光率(或吸光度),每支試管穩定時間要相同。
注意事項:在進行吸光度測定時,測量的OD值在0.2-0.8之間相對更準確,線性關係更好,若測得OD值超出範圍,可進行倍數稀釋再進行測定。
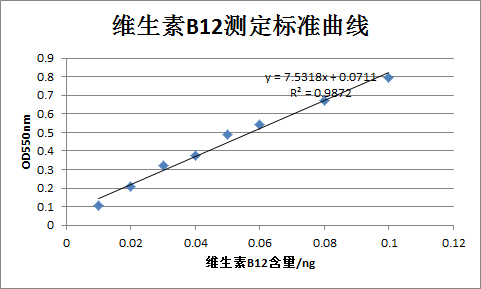
(8)標準曲線製作及計算:以維生素B12標準品的含量為橫坐標,透光率(吸光度)為縱坐標作標準曲線。
根據待測液的透光率(吸光度),從標準曲線中查得該待測液中維生素B12的濃度,再根據稀釋因子和稱樣量計算出試樣中維生素B12的含量。透光率(吸光度)超出標準曲線管S3~S10範圍的試樣管要舍去。
對每個編號的待測液的試管,用每支試管的透光率(吸光度)計算每毫升該編號待測液維生素B12的濃度,並計算該編號待測液的維生素B12濃度平均值,每支試管測得的該濃度不得超過該平均值的±15%,超過者要舍去。如果符合該要求的管數少於所有的四個編號的待測液的總管數的2/3,用於計算試樣含量的數據是不充分的,需要重新檢驗。如果符合要求的管數超過原來管數的2/3,重新計算每一編號的有效試樣管中每毫升測定液中維生素B12含量的平均值,以此平均值計算全部編號試樣管的總平均值為Cx。 用於計算試樣中的維生素B12含量。
維生素B12的含量按公式計算:X=Cx/m*f/1000*100
注:X是試樣中維生素B12的含量,單位為μg/100g;Cx是計算所得的維生素B12含量總平均值,單位為ng;m是試樣的質量,單位為g;f是稀釋倍數。
以重複性條件下獲得的兩次獨立測定結果的算術平均值表示,結果保留兩位有效數字。
八、實驗現象及標準曲線製作
(1)實驗現象:S3-S10試管呈梯度渾濁

(2)標準曲線製作
九、試驗關鍵點總結
(1)試驗用使用的玻璃容器、水、培養基等必須確保無維生素B12殘留,整個試驗過程操作要注意不能汙染維生素B12,否則會導致標準曲線線性關係差或做不出標準曲線;
(2)標準溶液製備過程中必須精確稱量、定容,若配製的標準溶液誤差過大會直接影響最終測定結果;
(3)使用的萊士曼乳杆菌要連續進行傳代至活力旺盛,且無雜菌汙染;在進行菌體離心-懸浮清洗的重複操作時,需確保清洗幹淨,不能有活化培養基殘留,殘留的培養基中可能含有維生素B12,對試驗結果造成不良影響;
(4)進行OD值測定時,盡可能保證測得吸光度範圍在0.2-0.8之間,若超出此範圍,可使用空白培養基進行倍數稀釋後再進行測定。
注:本文屬betway必威西汉姆联生物原創,未經允許不得轉載。
下一篇:普通變形杆菌和奇異變形杆菌的檢驗

