











一、《中國藥典》2020年版 四部 3301支原體檢查(培養法)
主細胞庫、工作細胞庫、病毒種子批、對照細胞以及臨床治療用細胞進行支原體檢查時,應同時進行培養法和指示細胞培養法(DNA染色法)。病毒類疫苗的病毒收獲液、原液采用培養法檢查支原體;必要時,亦可采用指示細胞培養法篩選培養基。也可采用經國家藥品檢定機構認可的其他方法。
1.1培養基
推薦使用的培養基:
支原體液體培養基:支原體肉湯培養基,精氨酸支原體肉湯培養基;
支原體半流體培養基:支原體半流體培養基,精氨酸支原體半流體培養基;
支原體固體培養基。
臨用前加入滅能小牛血清(培養基:血清為8:2),並可酌情加入適量青黴素,充分搖勻。
除上述推薦培養基外,亦可使用可支持支原體生長的其他培養基,但靈敏度必須符合要求。
培養基靈敏度檢查:采用變色單位試驗法(CCU);
判定:以接種後培養基管數的2/3以上呈現變色的最高稀釋度為該培養基的靈敏度。液體培養基的靈敏度,支原體肉湯接種肺炎支原體(ATCC 15531株)應達到10-8,精氨酸支原體肉湯接種口腔支原體(ATCC 23714株)應達到10-4。

肺炎支原體ATCC 15531在支原體肉湯及半流體中的生長狀態

口腔支原體ATCC 23714在精氨酸支原體肉湯及半流體中的生長狀態
1.2供試品檢查流程
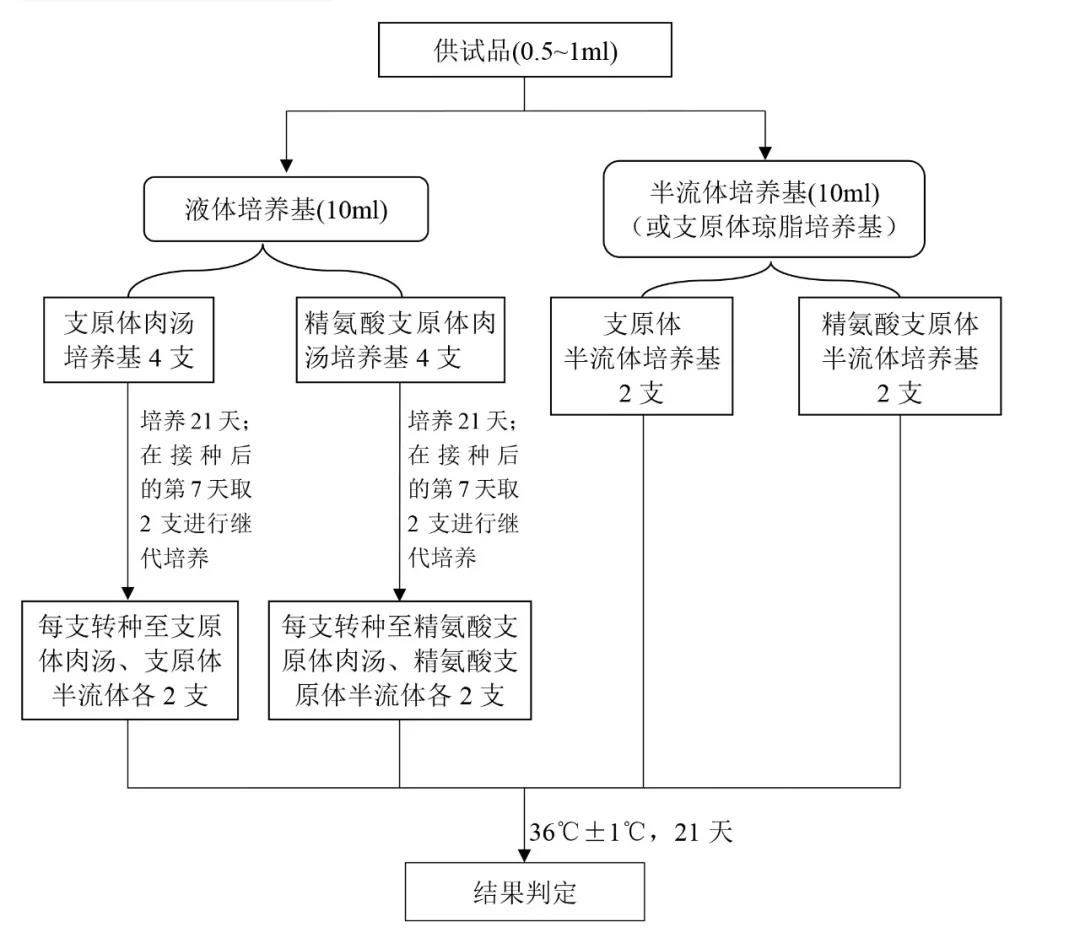
供試品如在分裝後24小時以內進行支原體檢查時可貯存於2~8℃;超過24小時應置於-20℃以下貯存。
培養條件:36℃±1℃培養21天,每隔3天觀察1次。
結果判定:培養結束時,如接種供試品的培養基均無支原體生長,則供試品判為合格。如疑有支原體生長,可取加倍量供試品複試,如無支原體生長,供試品判為合格;如仍有支原體生長,則供試品判為不合格。
二、美國藥典USP40MYCOPLASMA TESTS(CULTURE METHOD培養法)
2.1培養基
推薦使用的培養基:
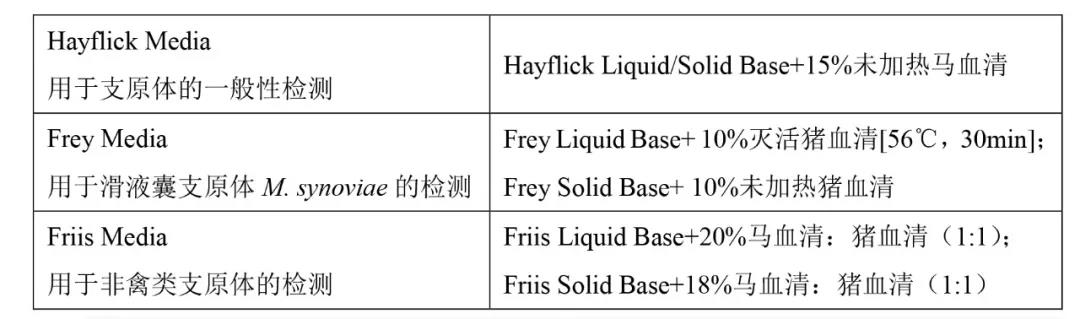
應使用足夠數量的固體和液體培養基進行測試,以確保在供試品(試驗物品/材料)中可能存在的少量支原體(約100cfu或100ccu)能夠被檢出。也可以使用其他培養基,但需符合標準要求。每批培養基都應進行適當的微生物檢測(營養特性)。
每次檢測應包含至少2株已知的支原體菌種或菌株[見表1],一株葡萄糖發酵型-肺炎支原體Mp或其等效種株;一株精氨酸水解型-口腔支原體Mo。隻有在檢測昆蟲細胞係時,才應包括螺原體(例如,S.citri ATCC 29747,S.melliferum ATCC 29416,或等效的菌種和菌株),其在營養需求方麵可能更挑剔一些,且需要較低的孵化溫度(昆蟲細胞係也是如此)。

表1 測試菌種
營養特性(培養基的微生物檢測):向100mL液體培養基和至少9mL固體培養基中接入不超過100cfu每種支原體,培養。按規定的時間間隔,吸取0.2 mL液體培養物到固體培養基進行繼代培養。使用顯微鏡觀察。
培養條件:
液體培養基36±1℃,密閉容器,20-21天;
固體培養基36±1℃,5~10% CO2,足夠濕潤,不少於14天。
判定:若固體培養基中支原體的菌落計數在0.5-log範圍內,則固體培養基符合要求(0.5-log:即接種數為100cfu,待測培養基中生長菌落數應在32-316cfu範圍內)。若液體培養基中每種測試菌的至少1次繼代培養物能夠在固體培養基中生長,則液體培養基符合要求。
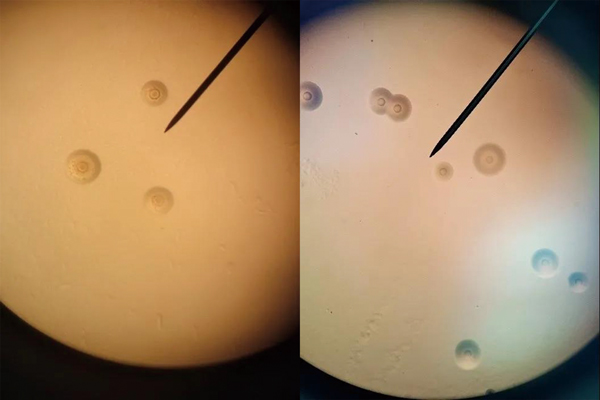
平板中的支原體菌落直徑0.01-0.5mm,呈圓形,中心致密,低倍顯微鏡觀察呈“煎蛋狀”,顯微圖片如下:
抑製物質(方法適用性):對供試品(試驗物品/材料)進行一次抑製物質檢測,當生產方法發生變化可能影響支原體檢測時,應重複進行抑製物質檢測。通過加入和不加入供試品,進行培養基的營養特性測試,以證明不含抑製物質。如果試驗微生物在沒有供試品的情況下比有的情況下更早發生一次以上的繼代培養,則說明存在抑製物質。同樣,如果直接用供試品接種的平板,其菌落數量不在沒有供試品接種的平板菌落數量的0.5-log單位範圍內,也說明存在抑製物質。在這兩種情況下,抑製物質必須通過適當的方法來中和或抵消它們的作用,例如通過使用不含抑製劑的底物或稀釋在更大體積的培養基中。如果使用稀釋,可以使用更大體積的培養基或可以分成幾個100ml三角瓶。中和或其他過程的有效性是通過重新進行抑製物質檢測來確認的。
2.2支原體檢測
供試品檢測流程如下:
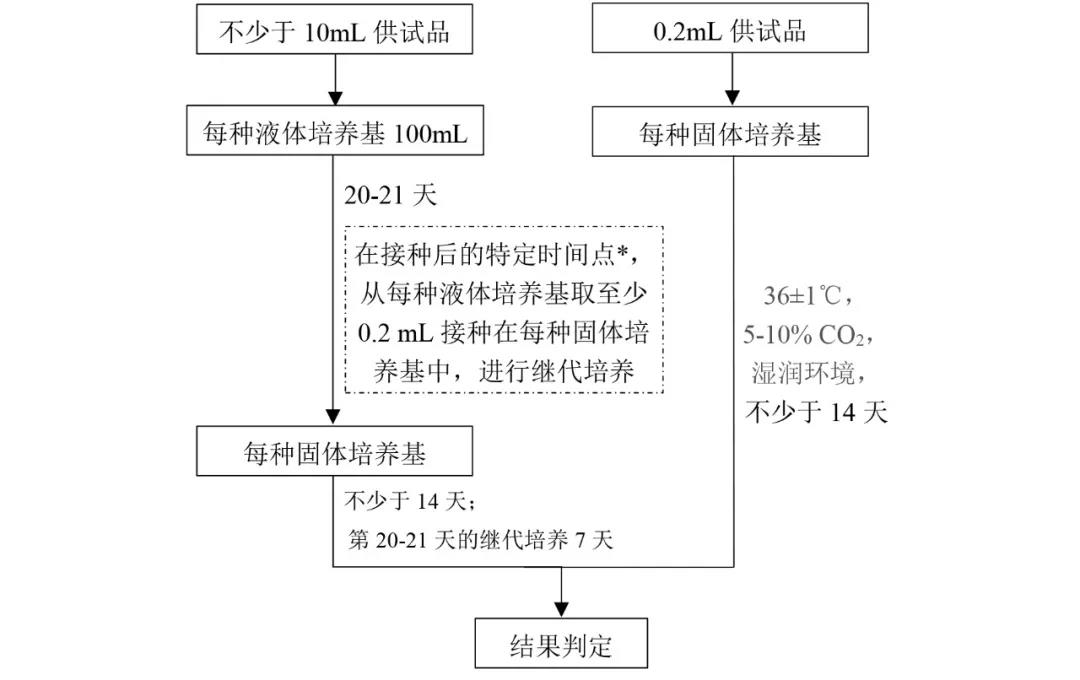
注:*特定時間點指接種後第2~4天、第6~8天、第13~15天,第19~21天。每2~3天觀察一次液體培養物,如果發生顏色變化,需進行繼代培養。
如果在加入供試品(試驗物品/材料)時發生顯著的pH值變化,可通過添加無菌氫氧化鈉或鹽酸溶液恢複到原來的pH值。
培養條件:36±1℃,5-10% CO2,足夠濕潤環境。
陽性對照:在固體培養基或液體培養基上,接種不超過100 cfu的至少一種測試菌。如果供試品的支原體檢測定期進行,建議定期輪換使用測試菌[見表1]。
陰性對照:未接種的100mL每種液體培養基和瓊脂平板作為陰性對照。
結果判定:在規定的培養周期結束時,檢查所有接種的固體培養基是否存在支原體菌落,如果沒有發現典型支原體菌落的生長,供試品符合要求。如果在任何固體培養基上出現典型支原體菌落生長,則供試品不符合要求。如果觀察到可疑菌落,使用合適的驗證方法確定是否由支原體引起。
如果液體培養基顯示細菌或真菌汙染,試驗無效。如果每個培養基和每個接種日至少有1個平板出現支原體菌落,則試驗是有效的。如果1個或1個以上陽性對照株在至少1個繼代平板上未顯示支原體生長,試驗無效。如果一個或更多的陰性對照顯示支原體生長,試驗無效。
三、培養基檢驗過程中注意事項
1) 抑製劑可使用青黴素20-80萬IU/L;
2) 製備平板(平皿直徑Ф60mm,不少於9mL培養基)時,應謹慎操作,防止氣泡形成;
3) 菌液製備:使用相應的支原體液體完全培養基作為稀釋液,依次進行10倍梯度稀釋;
四、小結:ChP2020和USP40中支原體檢測法的區別
1)推薦培養基、血清不同;
2)培養基驗收的檢測方法、判定不同;
3)供試品的檢測方法不同;
參考文獻
[1]《中國藥典》2020版四部通則 3301 支原體檢查法
[2] USP40MYCOPLASMA TESTS
支原體檢測用產品列表
|
HB7025 |
250g |
300 |
用於培養支原體的基礎培養基(含精氨酸、酚紅、葡萄糖;不含瓊脂) |
|
|
HB7025-1 |
250g |
360 |
用於支原體的分離培養(含精氨酸、葡萄糖、酚紅) |
|
|
HB7025-2 |
250g |
300 |
用於培養支原體的基礎培養基(含葡萄糖、酚紅;不含精氨酸) |
|
|
HB7025-3 |
250g |
360 |
用於支原體的分離培養(不含酚紅、精氨酸) |
|
|
HBPT7025-3 |
8ml/支*20支 |
300 |
用於藥品和生物製品中支原體檢測 |
|
|
HB7025-4 |
250g |
300 |
用於支原體的增菌培養(不含瓊脂、酚紅、精氨酸) |
|
|
HB7025-5 |
250g |
300 |
用於藥品和生物製品中支原體檢測(含精氨酸、含酚紅、葡萄糖) |
|
|
HBPT7025-5 |
8ml/支*20支 |
300 |
用於藥品和生物製品中支原體檢測(含精氨酸、含酚紅、葡萄糖) |
|
|
HB7025-6 |
250g |
360 |
用於支原體的培養(含葡萄糖;不含精氨酸、酚紅) |
|
|
HBPT7025-6 |
8ml/支*20支 |
300 |
用於藥品和生物製品中支原體檢測 |
|
|
HB7025-7 |
250g |
300 |
用於支原體培養(含酚紅、不含葡萄糖、瓊脂、精氨酸) |
|
|
HB7025-8 |
250g |
360 |
用於藥品和生物製品中口腔等支原體培養(含精氨酸、葡萄糖;不含酚紅) |
|
|
HB7025-9 |
250g |
360 |
用於支原體培養(含葡萄糖、精氨酸;不含酚紅) |
|
|
HBPT7025-81 |
8ml/支*20支 |
300 |
用於藥品和生物製品中支原體檢測 |
|
|
HB8475 |
250g |
400 |
用於培養支原體的基礎培養基(不含精氨酸、酚紅、葡萄糖) |
|
|
HB8475-1 |
250g |
500 |
用於支原體分離和培養的基礎培養基(不含精氨酸、酚紅、葡萄糖) |
|
|
HB8572-2 |
250g |
300 |
用於培養支原體的基礎培養基 |
上一篇:ELISA法檢測肺炎衣原體
下一篇:沒有了!

