











1 檢驗程序
嬰幼兒配方奶粉中嗜熱菌的檢驗程序見圖1。
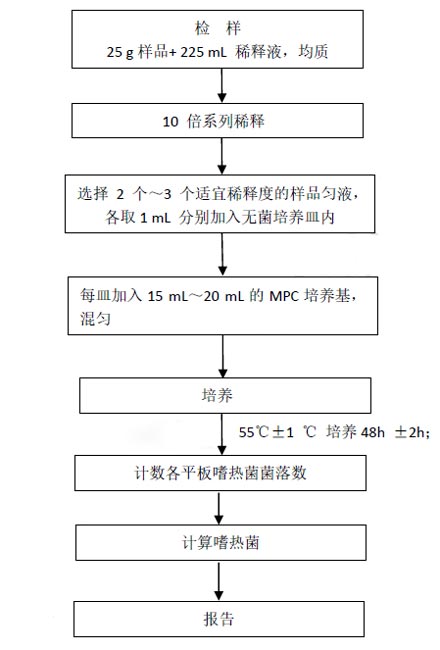
圖1 嗜熱菌的檢驗程序
2 操作步驟
2.1 樣品的稀釋
2.1.1 稱取25g樣品置於盛有225mL無菌磷酸鹽緩衝液或無菌生理鹽水的無菌均質杯內,8000r/min~10000r/min均質1min~2min,或放入盛有225mL稀釋液的無菌均質袋中,用拍擊式均質器拍打1min~2min,製成1:10的樣品勻液。
2.1.2 用1mL無菌吸管或微量移液器吸取1:10樣品勻液1mL,沿管壁緩慢注於盛有9mL稀釋液的無菌試管中(注意吸管或吸頭尖端不要觸及稀釋液麵),振搖試管或換用1支無菌吸管或吸頭反複吹打使其混合均勻,製成1:100的樣品勻液。
2.1.3 按2.1.2操作,製備10倍係列稀釋樣品勻液。每遞增稀釋一次,換用1次1mL無菌吸管或吸頭。
2.1.4 根據對樣品汙染狀況的估計,選擇2個~3個適宜稀釋度的樣品勻液,在進行10倍遞增稀釋時,吸取1mL樣品勻液於無菌培養皿內,每個稀釋度做兩個培養皿。同時,分別吸取1mL空白稀釋液加入兩個無菌培養皿內作空白對照。
2.1.5及時將15mL~20mL冷卻至46℃~50℃的MPC培養基(可放置於48℃±2℃恒溫裝置中保溫)傾注培養皿,並轉動培養皿使其混合均勻。
2.2 培養
水平放置待瓊脂凝固後,將平板翻轉,55℃±1℃培養48h ± 2h,培養過程中注意防止平板幹裂。
2.3 菌落計數
2.3.1 可用肉眼觀察,必要時用放大鏡或菌落計數器,記錄稀釋倍數和相應的菌落數量。菌落計數以菌落形成單位(colony forming unit,CFU)表示。
2.3.2 選取菌落數在30CFU~300CFU之間、無蔓延菌落生長的平板計嗜熱菌數。低於30CFU的平板記錄具體菌落數,大於300CFU的可記錄為多不可計。
3 嗜熱菌的計算方法
3.1 若隻有一個稀釋度平板上的菌落數在適宜計數範圍內,計算兩個平板菌落數的平均值,再將平均值乘以相應稀釋倍數,作為每g樣品中嗜熱菌結果。
3.2 若有兩個連續稀釋度的平板菌落數在適宜計數範圍內時,按式(1)計算:
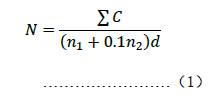
式中:
N ——樣品中嗜落菌菌落數;
ΣC——平板(含適宜範圍菌落數的平板)菌落數之和;
n1——第一稀釋度(低稀釋倍數)平板個數;
n2——第二稀釋度(高稀釋倍數)平板個數;
d ——稀釋因子(第一稀釋度)。
3.3 若所有稀釋度的平板上菌落數均大於300CFU,則對稀釋度最高的平板進行計數,其他平板可記錄為多不可計,結果按平均嗜落菌菌落數乘以最高稀釋倍數計算。
3.4 若所有稀釋度的平板菌落數均小於30CFU,則應按稀釋度最低的平均嗜落菌菌落數乘以稀釋倍數計算。
3.5 若所有稀釋度平板均無菌落生長,則以小於1乘以最低稀釋倍數計算。
3.6 若所有稀釋度的平板菌落數均不在30CFU~300CFU之間,其中一部分小於30CFU或大於300CFU時,則以最接近30CFU或300CFU的平均菌落數乘以稀釋倍數計算。
4 結果報告
4.1 菌落數小於100CFU時,按“四舍五入”原則修約,以整數報告。
4.2 菌落數大於或等於100CFU時,第3位數字采用“四舍五入”原則修約後,采用兩位有效數字,後麵用0代替位數;也可用10的指數形式來表示,按“四舍五入”原則修約後,采用兩位有效數字。
4.3 若空白對照上有菌落生長,則此次檢驗結果無效。
4.4 以CFU/g為單位報告。
附錄A培養基和試劑
A.1 含0.1%脫脂奶粉的平板計數瓊脂(MPC)培養基 點擊查看
A.1.1 成分
胰蛋白腖
5.0g
酵母浸膏
2.5g
葡萄糖
1.0g
脫脂奶粉
1.0g
瓊脂
10.0g~15.0g
蒸餾水
1000mL
A.1.2 製法
將上述成分加於蒸餾水中,煮沸溶解,調節pH至7.0±0.2。分裝試管或錐形瓶,121℃高壓滅菌15min。
注1:脫脂奶粉不應含有抗生素類物質。
注2:瓊脂用量根據其凝固程度決定。
A.2 無菌磷酸鹽緩衝液 點擊查看
A.2.1 成分
A.2.2 製法
磷酸二氫鉀(KH2PO4)
34.0g
蒸餾水
500mL
貯存液:稱取34.0 g的磷酸二氫鉀溶於500mL蒸餾水中,用大約175mL的1mol/L氫氧化鈉溶液調節pH至7.2,用蒸餾水稀釋至1000 mL後貯存於冰箱。
稀釋液:取貯存液1.25mL,用蒸餾水稀釋至1000mL,分裝於適宜容器中,121℃高壓滅菌15min。
A.3 無菌生理鹽水 點擊查看
A.3.1 成分
A.3.2 製法
氯化鈉
8.5g
蒸餾水
1000mL
稱取8.5g氯化鈉溶於1000mL蒸餾水中,121℃高壓滅菌15min。
相關產品:
0.85%無菌生理鹽水(10ml/支)-點擊查看產品詳情
上一篇:肺炎克雷伯菌檢驗標準操作程序
下一篇:無乳鏈球菌檢驗標準操作程序

