











無菌檢查法係用於檢查藥典要求無菌的藥品、生物製品、醫療器具、原料、輔料、及其他品種是否無菌的一種方法。若供試品符合無菌檢查法的規定,僅表明了供試品在該檢驗條件下未發現微生物汙染。
無菌檢查應在環境潔淨度B 級背景下的局部A 級潔淨度的單向流空氣區域內或隔離係統中進行,其全過程應嚴格遵守無菌操作,防止微生物汙染,防止汙染的措施不得影響供試品中微生物的檢出。單向流空氣區、工作台麵及環境應定期按《醫藥工業潔淨室(區)懸浮粒子、浮遊菌和沉降菌的測試方法》的現行國家標準進行潔淨度確認。隔離係統應定期按相關的要求進行驗證,其內部環境的潔淨度須符合無菌檢查的要求。日常檢驗還需對試驗環境進行監控。
無菌檢查人員必須具備微生物專業知識,並經過無菌技術的培訓。
培養基
硫乙醇酸鹽流體培養基主要用於厭氧菌的培養,也可用於需氣菌培養;胰酪大豆腖液體培養基適用於真菌和需氣菌的培養。培養基的製備及培養條件培養基可按以下處方製備,亦可使用按該處方生產的符合規定的脫水培養基。配製後應采用驗證合格的滅菌程序滅菌。製備好的培養基應保存在2~25℃、避光的環境,若保存於非密閉容器中,一般在3周內使用;若保存於密閉容器中,一般可在一年內使用。
1. 硫乙醇酸鹽流體培養基
酪腖 (胰酶水解) 15.0g 酵母浸出粉 5.0g
葡萄糖 5.0g 氯化鈉 2.5g
L-胱氨酸 0.5g 新配製的 0.1% 刃天青溶液 1.0ml
硫乙醇酸鈉 0.5g 瓊脂 0.75g
(或硫乙醇酸) ( 0.3 ml) 純化水 1000ml
除葡萄糖和刃天青溶液外,取上述成分混合,微溫溶解,調節pH 為弱堿性,煮沸,濾清,加入葡萄糖和刃天青溶液,搖勻,調節pH 值使滅菌後為7.1±0.2。分裝至適宜的容器中,其裝量與容器高度的比例應符合培養結束後培2養基氧化層(粉紅色)不超過培養基深度的1/2。滅菌。在供試品接種前,培養基氧化層的高度不得超過培養基深度的1/5,否則,須經100℃水浴加熱至粉紅色消失(不超過20 分鍾),迅速冷卻,隻限加熱一次,並防止被汙染。除另有規定外,硫乙醇酸鹽流體培養基置30~35℃培養。
2. 胰酪大豆腖液體培養基
胰酪腖 17.0g 氯化鈉 5.0g
大豆木瓜蛋白酶消化物 3.0g 磷酸氫二鉀 2.5g
葡萄糖(一水合/無水) 2.5g (2.3g) 純化水 1000mL
除葡萄糖外,取上述成分,混合,微溫溶解,濾過,調節pH 值使滅菌後在25℃的pH 值為7.3±0.2,加入葡萄糖,分裝,滅菌。胰酪大豆腖液體培養基置20~25℃培養。
3. 選擇性培養基
按上述硫乙醇酸鹽流體培養基或胰酪大豆腖液體培養基的處方及製法,在培養基滅菌或使用前加入適宜的中和劑、滅活劑或表麵活性劑,其用量同方法適用性試驗。
4. 0.5%葡萄糖肉湯培養基(用於硫酸鏈黴素等抗生素的無菌檢查)
腖 10.0g 氯化鈉 5.0g
葡萄糖 5.0g 水 1000 ml
牛肉浸出粉 3.0g
除葡萄糖外,取上述成分混合,微溫溶解,調節 pH 為弱堿性,煮沸,加入葡萄糖溶解後,搖勻,濾清,調節 pH 值使滅菌後在25℃的pH 值為7.2±0.2,分裝,滅菌。
5. 胰酪大豆腖瓊脂培養基
胰酪腖 15.0g 氯化鈉 5.0g
大豆木瓜蛋白酶水解物 5.0g 瓊脂 15.0g
純化水 1000ml
除瓊脂外,取上述成分,混合。微溫溶解,調節pH 值使滅菌後在25℃的pH 值為7.3±0.2,加入瓊脂,加熱溶化後,搖勻,分裝,滅菌。
6.沙氏葡萄糖液體培養基
動物組織胃蛋白酶水解物和胰酪腖等量混合物 10.0g
葡萄糖 20.0g 純化水 1000mL
除葡萄糖外,取上述成分,混合,微溫溶解,調節pH 值使滅菌後在25℃的pH 值為5.6±0.2,加入葡萄糖,搖勻,分裝,滅菌。
7. 沙氏葡萄糖瓊脂培養基
動物組織胃蛋白酶水解物和胰酪腖等量混合物 10.0g
葡萄糖 40.0g 純化水 1000mL
瓊脂 15.0g
除葡萄糖、瓊脂外,取上述成分,混合,微溫溶解,調節pH值使滅菌後在25℃的pH值為5.6±0.2,加入瓊脂,加熱溶化後, 再加入葡萄糖,搖勻,分裝,滅菌。
培養基的適用性檢查
無菌檢查用的硫乙醇酸鹽流體培養基和胰酪大豆腖液體培養基等應符合培養基的無菌性檢查及靈敏度檢查的要求。本檢查可在供試品的無菌檢查前或與供試品的無菌檢查同時進行。
無菌性檢查 每批培養基隨機取不少於5 支(瓶),置各培養基規定的溫度培養14 天,應無菌生長。
靈敏度檢查
菌種 培養基靈敏度檢查所用的菌株傳代次數不得超過5 代(從菌種保存中心獲得的冷凍幹燥菌種為第0 代),並采用適宜的菌種保存技術進行保存,以保證試驗菌株的生物學特性。
金黃色葡萄球菌(Staphylococcus aureus)〔CMCC(B) 26 003〕
銅綠假單胞菌(Pseudomonas aeruginosa) 〔CMCC(B) 10 104〕
枯草芽孢杆菌(Bacillus subtilis)〔CMCC(B)63 501〕
生孢梭菌(Clostridium sporogenes)〔CMCC(B) 64 941〕
白色念珠菌(Candida albicans)〔CMCC(F) 98 001〕
黑曲黴(Aspergillus niger) 〔CMCC(F) 98 003〕
菌液製備 接種金黃色葡萄球菌、銅綠假單胞菌、枯草芽孢杆菌的新鮮培養物至胰酪大豆腖液體培養基中或胰酪大豆腖瓊脂培養基上,接種生孢梭菌的新鮮培養物至硫乙醇酸鹽流體培養基中,30~35℃培養18~24 小時;接種白色念珠菌的新鮮培養物至沙氏葡萄糖液體培養基或沙氏葡萄糖瓊脂培養基上,20~25℃培養24~48 小時,上述培養物用0.9%無菌氯化鈉溶液製成每1ml 含菌數小於100CFU(菌落形成單位)的菌懸液。接種黑曲黴的新鮮培養 物至沙氏葡萄糖瓊脂斜麵培養基上,20~25℃培養5~7 天,加入3~5ml 含0.05%(v/v)聚山梨酯80 的0.9%無菌氯化鈉溶液,將孢子洗脫。然後,采用適宜的方法吸出孢子懸液至無菌試管內,用含0.05%(v/v)聚山梨酯80 的0.9%無菌氯化鈉溶液製成每1ml 含孢子數小於100CFU 的孢子懸液。
菌懸液在室溫下放置應在2 小時內使用,若保存在2~8℃可在24 小時內使用。黑曲黴孢子懸液可保存在2~8℃,在驗證過的貯存期內使用。
培養基接種 取每管裝量為12ml 的硫乙醇酸鹽流體培養基7 支,分別接種小於100CFU 的金黃色葡萄球菌、銅綠假單胞菌、生孢梭菌各2 支,另1 支不接種作為空白對照,培養3 天;取每管裝量為9ml 的胰酪大豆腖液體培養基7 支,分別接種小於100CFU 的枯草芽孢杆菌、白色念珠菌、黑曲黴各2 支,另1 支不接種作為空白對照,培養5 天。逐日觀察結果。
結果判定 空白對照管應無菌生長,若加菌的培養基管均生長良好,判該培養基的靈敏度檢查符合規定。
稀釋液、衝洗液及其製備方法
稀釋液、衝洗液配製後應采用驗證合格的滅菌程序滅菌。
1.0.1%蛋白腖水溶液 取蛋白腖1.0g,加水1000ml,微溫溶解,濾清,調節pH 值至7.1±0.2,分裝,滅菌。
2.pH7.0 氯化鈉-蛋白腖緩衝液 取磷酸二氫鉀3.56g,磷酸氫二鈉7.23g,氯化鈉4.30g,蛋白腖1.0g,加水1000ml,微溫溶解,濾清,分裝,滅菌。
3. 根據供試品的特性,可選用其他經驗證過的適宜的溶液作為稀釋液、衝洗液(如0.9%無菌氯化鈉溶液)。
如需要,可在上述稀釋液或衝洗液的滅菌前或滅菌後加入表麵活性劑或中和劑等。
方法適用性試驗
當進行產品無菌檢查法時,應進行方法適用性試驗,以確認所采用的方法適合於該產品的無菌檢查。若檢驗程序或產品發生變化可能影響檢驗結果時,應重新進行方法適用性試驗。
方法適用性試驗按“供試品的無菌檢查”的規定及下列要求進行操作。對每一試驗菌應逐一進行方法確認。
菌種及菌液製備 除大腸埃希菌(Escherichia coli)[CMCC(B) 4 4102〕外,金黃色葡萄球菌、枯草芽孢杆菌、生孢梭菌、白色念珠菌、黑曲黴同培養基靈敏度檢查。大腸埃希菌的菌液製備同金黃色葡萄球菌。
薄膜過濾法 取每種培養基規定接種的供試品總量按薄膜過濾法過濾,衝洗,在最後一次的衝洗液中加入小於100CFU 的試驗菌,過濾。加硫乙醇酸鹽流體培養基或胰酪大豆腖液體培養基至濾筒內。另取一裝有同體積培養基的容器,加入等量試驗菌,作為對照。置規定溫度培養3~5 天,各試驗菌同法操作。
直接接種法 取符合直接接種法培養基用量要求的硫乙醇酸鹽流體培養基6 管,分別接入小於100CFU 的金黃色葡萄球菌、大腸埃希菌、生孢梭菌各2 管,取符合直接接種法培養基用量要求的胰酪大豆腖液體培養基6 管,分別接入小於100CFU 的枯草芽孢杆菌、白色念珠菌、黑曲黴各2 管。其中1 管接入每支培養基規定的供試品接種量,另1 管作為對照,置規定的溫度培養3~5 天。
結果判斷 與對照管比較,如含供試品各容器中的試驗菌均生長良好,則說明供試品的該檢驗量在該檢驗條件下無抑菌作用或其抑菌作用可以忽略不計,照此檢查方法和檢查條件進行供試品的無菌檢查。 如含供試品的任一容器中的試驗菌生長微弱、緩慢或不生長,則說明供試品的該檢驗量在該檢驗條件下有抑菌作用,應采用增加衝洗量、增加培養基的用量、使用中和劑或滅活劑、更換濾膜品種等方法,消除供試品的抑菌作用,並重新進行方法適用性試驗。
方法適用性試驗也可與供試品的無菌檢查同時進行。
供試品的無菌檢查
無菌檢查法包括薄膜過濾法和直接接種法。隻要供試品性質允許,應采用薄膜過濾法。供試品無菌檢查所采用的檢查方法和檢驗條件應與方法適用性試驗確認的方法相同。
無菌試驗過程中,若需使用表麵活性劑、滅活劑、中和劑等試劑,應證明其有效性,且對微生物無毒性。
檢驗數量 檢驗數量是指一次試驗所用供試品最小包裝容器的數量。除另有規定外,出廠產品按表1 規定;上市產品監督檢驗按表2 規定。表1、表2中最少檢驗數量不包括陽性對照試驗的供試品用量。
檢驗量 是指供試品每個最小包裝接種至每份培養基的最小量(g 或ml)。除另有規定外,供試品檢驗量按表3 規定。若每支(瓶)供試品的裝量按規定足夠接種兩種培養基,則應分別接種硫乙醇酸鹽流體培養基和胰酪大豆腖液體培養基。采用薄膜過濾法時,隻要供試品特性允許,應將所有容器內的全部內容物過濾。
陽性對照 應根據供試品特性選擇陽性對照菌:無抑菌作用及抗革蘭陽性菌為主的供試品,以金黃色葡萄球菌為對照菌;抗革蘭陰性菌為主的供試品以大腸埃希菌為對照菌;抗厭氧菌的供試品,以生孢梭菌為對照菌;抗真菌的供試品,以白色念珠菌為對照菌。陽性對照試驗的菌液製備同方法適用性試驗,加菌量小於100CFU,供試品用量同供試品無菌檢查時每份培養基接種的樣品量。陽性對照管培養48~72 小時應生長良好。
陰性對照 供試品無菌檢查時,應取相應溶劑和稀釋液、衝洗液同法操作,作為陰性對照。陰性對照不得有菌生長。
供試品處理及接種培養基
操作時,用適宜的消毒液對供試品容器表麵進行徹底消毒,如果供試品容器內有一定的真空度,可用適宜的無菌器材(如帶有除菌過濾器的針頭)向容器內導入無菌空氣,再按無菌操作啟開容器取出內容物。除另有規定外,按下列方法進行供試品處理及接種培養基。
1.薄膜過濾法
薄膜過濾法應采用封閉式薄膜過濾器。無菌檢查用的濾膜孔徑應不大於0.45μm。直徑約為50mm。根據供試品及其溶劑的特性選擇濾膜材質。抗生素供試品應選擇低吸附的濾器及濾膜。濾器及濾膜使用前應采用適宜的方法滅菌。使用時,應保證濾膜在過濾前後的完整性。
水溶性供試液過濾前應先將少量的衝洗液過濾以潤濕濾膜。油類供試品,其濾膜和過濾器在使用前應充分幹燥。為發揮濾膜的最大過濾效率,應注意保持供試品溶液及衝洗液覆蓋整個濾膜表麵。供試液經薄膜過濾後,若需要用衝洗液衝洗濾膜,每張濾膜每次衝洗量一般為100ml,且總衝洗量不得超過1000ml,以避免濾膜上的微生物受損傷。
水溶液供試品 取規定量,直接過濾,或混合至含不少於100ml 適宜稀釋液的無菌容器中,混勻,立即過濾。如供試品具有抑菌作用,須用衝洗液衝洗濾膜,衝洗次數一般不少於三次,所用的衝洗量、衝洗方法同方法適用性試驗。除生物製品外,一般樣品衝洗後,1 份濾器加入100ml 硫乙醇酸鹽流體培養基,1 份濾器加入100ml 胰酪大豆腖液體培養基。生物製品樣品衝洗後, 2 份濾器加入100ml 硫乙醇酸鹽流體培養基,1 份濾器加入100ml 胰酪大豆腖液體培養基。
水溶性固體供試品 取規定量,加適宜的稀釋液溶解或按標簽說明複溶,然後照水溶液供試品項下的方法操作。
非水溶性供試品 取規定量,直接過濾;或混合溶於適量含聚山梨酯80或其他適宜乳化劑的稀釋液中,充分混合,立即過濾。用含0.1~1%聚山梨酯80 的衝洗液衝洗濾膜至少3 次。加入含或不含聚山梨酯80 的培養基。接種培養基照水溶液供試品項下的方法操作。
可溶於十四烷酸異丙酯的膏劑和粘性油劑供試品 取規定量,混合至適量的無菌十四烷酸異丙酯①中,劇烈振搖,使供試品充分溶解,如果需要可適當加熱,但溫度不得超過44℃,趁熱迅速過濾。對仍然無法過濾的供試品,於含有適量的無菌十四烷酸異丙酯中的供試液中加入不少於100ml 的稀釋液,充分振搖萃取,靜置,取下層水相作為供試液過濾。過濾後濾膜衝洗及接種培養基照非水溶性製劑供試品項下的方法操作。
無菌氣(噴)霧劑供試品 取規定量,將各容器置-20℃以下的冰室冷凍約1 小時。以無菌操作迅速在容器上端鑽一小孔,釋放拋射劑後再無菌開啟容器,並將供試液轉移至無菌容器中,然後照水溶液或非水溶性製劑供試品項下的方法操作。
裝有藥物的注射器供試品 取規定量,將注射器中的內容物(若需要可吸入稀釋液或標簽所示的溶劑溶解)直接過濾,或混合至含適宜稀釋液的無菌容器中,然後按水溶液或非水溶性供試品項下方法操作。同時應采用適宜的方法進行包裝中所配帶的無菌針頭的無菌檢查。
具有導管的醫療器具(輸血、輸液袋等)供試品 取規定量,每個最小包裝用50~100ml 衝洗液分別衝洗內壁,收集衝洗液於無菌容器中,然後照水溶液供試品項下方法操作。同時應采用直接接種法進行包裝中所配帶的針頭的無菌檢查。
2. 直接接種法
直接接種法適用於無法用薄膜過濾法進行無菌檢查的供試品,即取規定量供試品分別等量接種至硫乙醇酸鹽流體培養基和胰酪大豆腖液體培養基中。除生物製品外,一般樣品無菌檢查時兩種培養基接種的支/瓶數相等;生物製品無菌檢查時硫乙醇酸鹽流體培養基和胰酪大豆腖液體培養基接種的支/瓶數為2:1。除另有規定外,每個容器中培養基的用量應符合接種的供試品體積不得大於培養基體積的10%,同時,硫乙醇酸鹽流體培養基每管裝量不少於15ml,胰酪大豆腖液體培養基每管裝量不少於10ml。供試品檢查時,培養基的用量和高度同方法適用性試驗。
混懸液等非澄清水溶液供試品 取規定量,等量接種至各管培養基中。
固體供試品 取規定量,直接等量接種至各管培養基中。或加入適宜的溶劑溶解,或按標簽說明複溶後,取規定量等量接種至各管培養基中。
非水溶性供試品 取規定量,混合,加入適量的聚山梨酯80 或其它適宜的乳化劑及稀釋劑使其乳化,等量接種至各管培養基中。或直接等量接種至含聚山梨酯80 或其它適宜乳化劑的各管培養基中。
敷料供試品 取規定數量,以無菌操作拆開每個包裝,於不同部位剪取約100mg 或1cm×3cm 的供試品,等量接種於各管足以浸沒供試品的適量培養基中。
腸線、縫合線等供試品 腸線、縫合線及其它一次性使用的醫用材料按規定量取最小包裝,無菌拆開包裝,等量接種於各管足以浸沒供試品的適量培養基中。
滅菌醫用器具供試品 取規定量,必要時應將其拆散或切成小碎段,等量接種於各管足以浸沒供試品的適量培養基中。
放射性藥品 取供試品1 瓶(支),等量接種於裝量為7.5ml 的硫乙醇酸流液體培養基和胰酪大豆腖液體培養基中。每管接種量為0.2ml。
培養及觀察
將上述接種供試品後的培養基容器分別按各培養基規定的溫度培養14天;接種生物製品供試品的硫乙醇酸鹽流體培養基的容器應分成兩等份,一份置30~35℃培養,一份置20~25℃培養。培養期間應逐日觀察並記錄是否有菌生長。如在加入供試品後或在培養過程中,培養基出現渾濁,培養14 天後,不能從外觀上判斷有無微生物生長,可取該培養液適量轉種至同種新鮮培養基中,培養3 天,觀察接種的同種新鮮培養基是否再出現渾濁;或取培養液塗片,染色,鏡檢,判斷是否有菌。
結果判斷
陽性對照管應生長良好,陰性對照管不得有菌生長。否則,試驗無效。若供試品管均澄清,或雖顯渾濁但經確證無菌生長,判供試品符合規定;若供試品管中任何一管顯渾濁並確證有菌生長,判供試品不符合規定,除非能充分證明試驗結果無效,即生長的微生物非供試品所含。當符合下列至少一個條件時方可判試驗結果無效:
(1)無菌檢查試驗所用的設備及環境的微生物監控結果不符合無菌檢查法的要求。
(2)回顧無菌試驗過程,發現有可能引起微生物汙染的因素。
(3)供試品管中生長的微生物經鑒定後,確證是因無菌試驗中所使用的物品和(或)無菌操作技術不當引起的。
試驗若經確認無效,應重試。重試時,重新取同量供試品,依法檢查,若無菌生長,判供試品符合規定;若有菌生長,判供試品不符合規定。
表1 批出廠產品及生物製品的原液和半成品最少檢驗數量
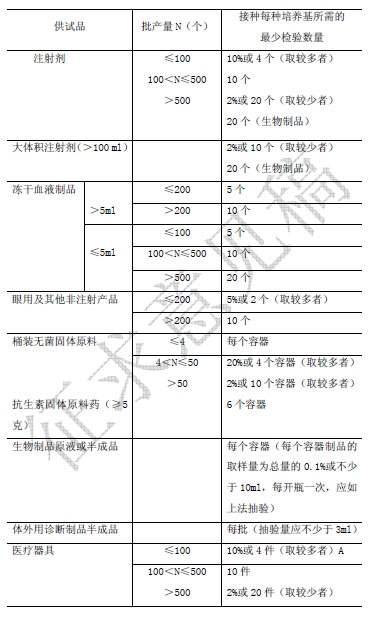
表2. 上市抽驗樣品的最少檢驗數量
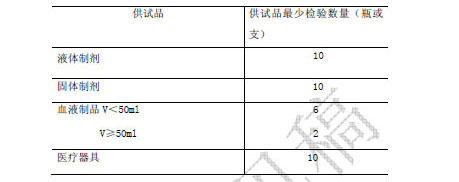
注:1.若供試品每個容器內的裝量不夠接種兩種培養基,那麽表中的最少檢驗數量加倍。
2.抗生素粉針劑(≥5 克)及抗生素原料藥(≥5 克)的最少檢驗數量為6 瓶(或支)。桶裝固體原料的最少檢驗數量為4 個包裝。
表3. 供試品的最少檢驗量
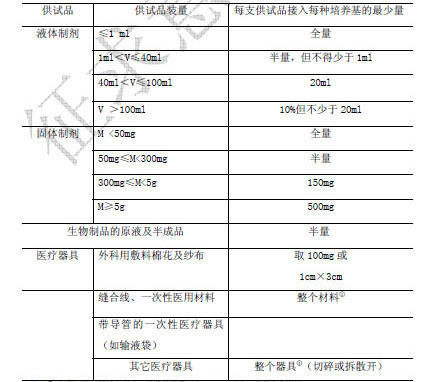
注:① 如果醫用器械體積過大,培養基用量可在2000ml 以上,將其完全浸沒。
說明:
1.無菌檢查法收載於《中國藥典》一、二、三部附錄中,一部和二部內容一致。
2.本稿以2010 年版二部的“無菌檢查法”為基礎進行中的內容進行一、二及三部內容的整合,並進行了修訂。
3..整合稿保留了生物製品無菌檢查法的特點,如檢驗數量、硫乙醇酸鹽培養基接種份數和培養溫度等。
4..修訂稿中檢驗環境修訂為“B 級背景下的A 級”。
5.改良馬丁培養基修訂為“胰酪大豆腖液體培養基”。
6.方法驗證試驗修訂為方法適用性試驗。
7.由於培養基的改變,培養基的靈敏度和方法適用性試驗也進行了修訂。
8.修訂了表1、表2、表3 的內容。

