











肉毒梭菌及肉毒毒素的檢驗
1 範圍
本標準規定了肉毐梭菌及肉毒毐素的檢驗方法。
本標淮適用於各類食品和食物中毒樣品中肉毒梭菌及肉毒毒素的檢驗。
2規範性引用文件
下列文件中的條款通過本標準的引用而成為本標準的條款.凡是注日期的引用文件,其隨後所有的修改單(不包括勘誤的內容〉或修訂版均不適用於本標準,然而,鼓勵根據本標準達成協議的各方研究是否可使用這些文件的最新版本。凡是不注日期的引用文件,其最新版本適用於本標準。
GB/T 4789.28-2003食品衛生微生物學檢驗染色法、培養基和試劑。
3設備和材料
3.1 冰箱:0℃-4℃。
3.2 恒溫培養箱士 30℃±1、35℃±1、36℃±1.
3.3 離心機:3 000r/min.
3.4 顯微鏡:10×〜100×,
3.5 相差顯微鏡。
3.6 均質器或滅菌乳鉢。
3.7 架盤藥物天平:0g〜500g,精確至0.5g
3.8 厭氧培養裝罝:常溫催化除氧式或堿性焦性沒石子酸除氧式。
3.9 滅菌吸管:1ml(具0.01ml刻度〕、10ml(具0.1ml刻度〕。
3.10 滅菌平皿:直徑90mm.
3.11 滅菌錐形瓶500ml.
3.12 滅菌注射器1ml.
3.13 小白鼠:12g〜15g。
4培養基和試劑
4.1 庖肉培養基GB/T 4789.28—2003中 4.67。
4.2 卵黃瓊臘培養基GB/T 4789,28-2003中4.68。
4.3 明膠磷酸鹽緩衝液GB/T 4789.28—2003中3.23。
4.4 肉毒分型抗毒診斷血清。
4.5 胰酶:活力1 : 250。
4.6 革蘭氏染色液:GB/T 4789.28—2003 中 2.2.
5檢驗程序
肉毒梭菌及肉毒毒素檢驗程序見圖1
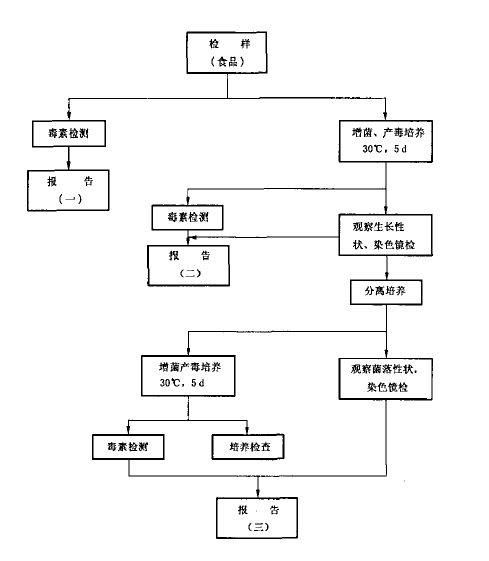
注1:報告(一):檢樣含有某型肉毒毒素。
注2:報告(二):檢樣含有某型肉毒梭菌,
注3:報告(三):由樣品分離的菌株為某型肉毒梭菌
如上所示,檢樣經均質處理後及時接種培養,進行增菌、產毒,同時進行毒素檢測試驗。毒索檢測試驗結果可證明檢樣中有無肉毒毒素以及有何型肉毒毒素存在.對增菌產毒培養物,一方麵做一般的生長特性觀察,同時檢測肉毒毒素的產生情況。所得結果可證明檢樣中有無肉毒梭菌以及有何型肉毒梭菌存在。為其他特殊目的而欲獲純菌株,可用增菌產毒培養物進行分離培養,對所得純菌株進行形態、培養特性等觀察及毒素檢測,其結果可證明所得純菌為何型肉毒梭菌。
6操作步驟
6.1肉毒毒素檢測
液狀檢樣可直接離心,固體或半流動檢樣須加適量(例如等量、倍量或5倍量、10倍量)明膠磷酸鹽緩衝液,浸泡、研碎,然後離心,取上清液進行檢測。另取一部分上清液,調PH6.2,每9份加10%胰酶(活力1:250〉水溶液1份,混勻,不斷輕輕攪動,37℃作用60min,進行檢測。
肉毒毒素檢測以小白鼠腹腔注射法為標準方法。
6.1.1檢出試驗:取上述離心上清液及其胰酶激活處理液分別注射小白鼠三隻,每隻0.5ml,觀察4d注射液中若有肉毒毒素存在,小白鼠一般多在注射後24h內發病、死亡。主要症狀為豎毛、四肢癱軟,呼吸困難,呼吸呈風箱式,腰部凹陷,宛若蜂腰,最終死於呼吸麻痹。如遇小鼠猝死以至症狀不明顯時,則可將注射液做適當稀釋,重做試驗。
6.1.2確證試驗:不論上清液或其胰酶激活處理液,凡能致小鼠發病、死亡者,取樣分成三份進行試驗,—份加等量多型混合肉毒抗毒診斷血清,混勻,37℃作用30min,一份加等量明膠磷酸鹽緩衝液,混勻,煮沸10min,一份加等量明膠磷酸鹽緩衝液,混勻即可,不做其他處理。三份混合液分別注射小白鼠各兩隻,每隻0.5ml觀察4d若注射加診斷血淸與煮沸加熱的兩份混合液的小白鼠均獲保護存活,而唯有注射未經其他處理的混合液的小白鼠以特有的症狀死亡,則可判定檢樣中的肉毒毒素存在,必要時要進行毒力測定及定型試驗。
6.1.3毒力測定:取已判定含有肉毒毒素的檢樣離心上清液,用明膠磷酸鹽緩衝液做成50倍、500倍及5 000倍的稀釋液,分別注射小白鼠各兩隻,每隻0.5ml,觀察4d根據動物死亡情況,計算檢樣所含肉毒毒素的大體毒力(MLD/ml或MLD/g)例如:5倍、50倍及500倍稀釋致動物全部死亡,而注射5 000倍稀釋液的動物全部存活,則可大體判定檢樣上清液所含毒素的毒力為1 000MLD/ml〜10 000 MLD/ml.
6.1.4定型試驗:按毒力測定結果,用明膠磷酸鹽緩衝液將檢樣上清液稀釋至所含毒素的毒力大體在10MLD/ml~1 000 MLD/ml的範圍,分別與各單型肉毒抗診斷血清等量混勻,37℃作用30min,各注射小鼠兩隻,每隻0.5 ml,觀察4d同時以明膠磷酸鹽緩衝液代替診斷血清,與稀釋毒素液等量混合作為對照。能保護動物免於發病、死亡的診斷血清型即為檢樣所含肉毒毒素的型別。
注1:未經胰酶激活處理的檢樣的毒索檢出試驗或確證試驗若為陽性結果,則胰酶激活處理液可省略毒力測定及定型試驗。
注2:為爭取時間盡快得出結果,母崠檢測的各項試驗也可同時進行。
注3:根據具體條件和可能性,定型試驗可酌清先省略C/D/F及G型。
注4:進行確證及定型等中和試驗時,檢樣的稀釋應參照所用肉毐診斷血清的效價。
注5:試驗動物的觀察可按陽性結果的出現隨時結束,以縮短觀察時間;唯有出現陰性結果時,應保留充分的觀察時間。
6.2肉毒梭菌檢出(增菌產毒培養試驗〉
取庖肉培養基三支,煮沸10min-15min,做如下處理:
a笫一支:急速冷卻,接種檢樣均質液1ml〜2ml。
b第二支:冷卻至601,接種檢樣,繼續於60℃保溫10 min急速冷卻;
c第三支:接種檢樣,繼續煮沸加熱10min,急速冷卻。
以上接種物於30℃培養5d若無生長,可再培養10d培養到期,若有生長,取培養液離心,以其上清液進行毒素檢測試驗,方法同6.1,陽性結果證明檢樣中有肉毒梭菌存在。
6.3分離培養
選取經毐索檢測試驗證實含有肉毒梭菌的前述增菌產毐培養物(必要時可重複一次適宜的加熱處理)接種卵黃瓊脂平板,35℃厭氧培養48h。肉毒梭菌在卵黃瓊脂平板上生長時,菌落及周圍培養基表麵覆蓋著特有的虹彩樣(或珍珠層樣〉薄層,但6型菌無此現象。
根據菌落形態及菌體形態祧取可疑菌落,接種庖肉培養基,於30攝氏度培養5d,進行毒素檢測及培養特性檢查確證試驗。
6.3.1毒素檢測:試驗方法同6.1。
6.3.2培養特性檢查:接種卵黃瓊脂平板,分成兩份,分別在35℃的需氧和厭氧條件下培養48h觀察生長情況及菌落形態。肉毒梭菌隻有在厭氧條件下才能在卵黃瓊脂平板上生長並形成具有上述特征的菌落,而在需氧條件下則不生長。
注:為檢出蜂蜜中存在的肉毒梭菌,蜂蜜檢樣需預濕37℃(流質蜂蜜〉,或52℃-53℃(晶質蜂蜜〉,充分攪拌後立即稱取20g溶於100ml滅菌蒸餾水37℃或52℃~53℃,攪拌稀釋,以8 000r/min-100000r/min離心30min(20℃),沉澱,加滅菌蒸餾水1ml。充分搖勻,等分各半,接種庖肉培養基(8ml-10ml)各一支,分別在30℃及37℃下厭氧培養7d按6.2進行肉毒毒素檢測.
上一篇:鐮刀菌毒素生殖發育毒性
下一篇:出入境口岸食源性疾病監測規程

