











與USP35版、EP7.0版、JP16版比較,2015版中國藥典微生物學檢驗體係規劃收載的項目和內容已基本趨向一致,將使我國藥典的微生物學檢驗成為一個比較完備的標準體係,其意義在於:
1、全麵與國際藥典標準接軌;
2、從對終產品的檢驗向過程控製轉變。
1、實驗室環境的重大修訂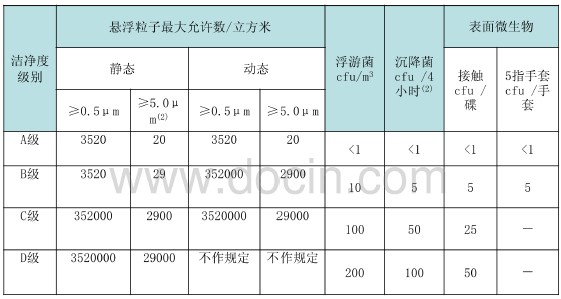
潔淨級別
英製標準中把1立方英尺中直徑≥0.5μm的微粒數作為潔淨級別的級別,100級,指每立方英尺中的粒子數有100個。(1米=3.28英尺 1立方米=35.29立方英尺)公製級別以立方米中微粒對數命名,如M3.5相當於英製中的100級。
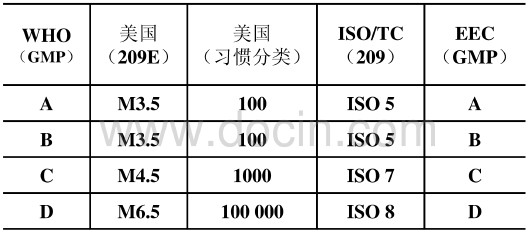
USP36<1116>引用了209E、ISO對潔淨級別劃分標準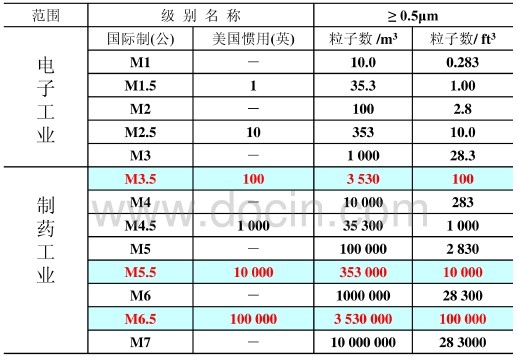
潔淨區懸浮粒子分類係統對照表
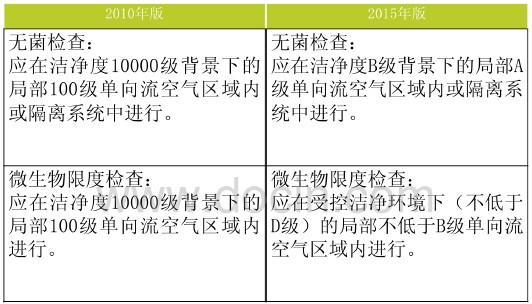
按實驗性質修訂微生物學檢驗環境潔淨度
2、培養基係統的重大修訂
修訂依據:
通過科研課題的建立及大量實驗,以國際品牌培養基為對照,考察了中國藥典微生物限度檢查法,無菌檢查法中所用國產培養基與USP/BP/JP中所規定的培養基的促進生長能力比較,得出大量的實驗數據,並經過可靠的統計分析,為整體微生物檢驗培養基的修訂提供了有利的技術支持。
修訂意義:
(1)糾正了我國在微生物檢驗係統中長期存在的對微生物分類培養的概念,提高汙染微生物的檢查可能。
(2)與先進國家所要的培養及一致,為實現結果互認打下重要基礎。
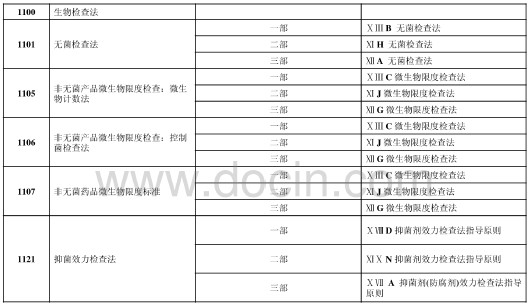
3、對一、二、三部微生物學附錄的整合、修訂
上一篇:檢測實驗室基礎知識匯
下一篇:2015年版藥典抑菌劑效力檢查法

