











阪崎腸杆菌(Enterobacter sakazakii),又名黃色陰溝腸杆菌, 為腸杆菌科腸杆菌屬的一個種,1980 年改名為阪崎腸杆菌[1]。阪崎腸杆菌主要危害嬰兒,導致腦膜炎、敗血症及小腸結腸壞死等;也有小部分成人感染骨髓炎和菌血症的報道,雖然有抗生素的治療,但總體死亡率高達80 %。目前, 該菌感染源頭還不十分清楚,但多數報告表明奶粉是主渠道。
奶粉中阪崎腸杆菌的汙染問題引起了FAO/WHO及各國的高度重視。FAO/WHO 於2004 年5 月2 日~5日在日內瓦召開了“嬰兒配方奶粉中阪崎腸杆菌和其他微生物” 研討會。會議報告將嬰兒配方奶粉中病原微生物分成3 類, 其中阪崎腸杆菌與腸炎沙門氏菌並列被認為A 類病原微生物,即該類病原菌在流行病學和微生物學上都有令人信服的證據表明被汙染的嬰兒奶粉是嬰兒患病的傳播媒介和傳染源。
我國於2005 年8 月頒布了檢驗檢疫行業標準《奶粉中阪崎腸杆菌檢測方法》共分為三個部分,分別規定了分離計數法、普通PCR 法及實時熒光PCR 法,供不同條件的實驗室選擇使用。
1 材料
1.1 菌株
阪崎腸杆菌ATCC29544、12868、29004。
1.2 試劑
腸杆菌增菌肉湯,MLST 增菌液(每升含有胰酪腖20 g,氯化鈉34.22 g,乳糖5.0 g,磷酸氫二鉀2.75 g,磷酸二氫鉀2.75 g,月桂基硫酸鈉0.1 g, 萬古黴素10 mg,pH7); 腦心浸液(bioMérieux);營養瓊脂,顯色培養基瓊脂(Xα-GlcA),氧化酶試驗試劑(bioMérieux); 細菌全基因組DNA 提取試劑盒,引物:5’-GGGTTGTCTGCGAAAGCGAA-3’、5’-GTCTTCGTGCTGCGAGTTTG-3’;PCR 試劑盒,100 bp DNA ladder,瓊脂糖,10×loading buffer,5×TBE (Tris54 g,0.5 mol/L EDTA pH8.0 20 mL,硼酸27.5 g,加蒸餾水至1 000 mL)。
1.3 儀器
離心機(Eppendorf, 5417R, Germany); PCR 擴增儀(MJ Research, PTC-200,American); 電泳儀(Hoefer,PS3000, American);凝膠成像儀(Bio-Rad, T2A, Italy);VITEK 生化鑒定係統。
2 方法
2.1 分離與計數法
取樣前消毒樣品包裝的開啟處和取樣勺。無菌稱取樣品100 g 3 份,至2 L 的樣品稀釋瓶中,加入900 mL預熱到45 ℃的滅菌蒸餾水, 振搖使樣品充分混勻,36 ℃±1℃培養18 h~22 h。移取增菌液10mL 加入90mLEE肉湯中,36℃±1℃培養18 h~22 h。每份增菌液用接種環接種Xα-GlcA 平板,三區法或四區法劃線,以得到單個菌落。將平板置36 ℃±1 ℃培養18 h~22 h。觀察平板上阪崎腸杆菌的典型形態:藍綠色菌落,圓形,直徑1 mm~2 mm。挑取可疑菌落, 接種營養瓊脂36℃±1℃培養18 h~22 h, 進行革蘭氏染色為陰性杆菌,氧化酶試驗陰性,用VITEK 生化鑒定係統進行生化鑒定。
2.2 普通PCR 檢測法
2.2.1 增菌
無菌稱取奶粉試樣100 g 3 份, 加到已預熱的44 ℃ 900 mL MLST 中,振搖使樣品充分混勻後, 44 ℃恒溫培養22 h~24 h。在液麵1 cm 以下取MLST 增菌液0.2 mL 加到裝有5 mL BHI 的小試管中,混勻,36 ℃±1 ℃恒溫水浴4 h,水麵要高於試管中培養基高度。
2.2.2 模板DNA 提取
取BHI 增菌液1.5 mL,10 000 r/min 離心2 min,盡量倒盡上清液。按細菌基因組DNA 提取試劑盒操作說明書提取模板DNA, 所提取的模板DNA 溶於50 μLTE 中。
同時用煮沸法提取增菌液DNA。BHI 增菌液1.5mL,10 000 r/min 離心2 min, 倒盡上清液沉澱溶於50 μLTE 中,煮沸5 min,10 000 r/min 離心2 min,取上清液備用。
剩餘BHI 增菌液36 ℃±1 ℃恒溫過夜培養, 以備確證試驗使用。
2.2.3 PCR 擴增
反應條件:94 ℃預變性5 min,94 ℃變性30 s,57 ℃退火30 s,72 ℃延伸30 s, 進行35 個循環,72 ℃延伸5 min,4 ℃下保存。反應體係見表1。
2.2.4 質控
檢測過程中要設陽性對照、陰性對照和空白對照。分別接種阪崎腸杆菌和金黃色葡萄球菌到10 mLNB 中,36 ℃±1 ℃過夜培養, 各取1.5 mL 增菌液,離心,提取DNA 模板。阪崎腸杆菌DNA 模板作陽性對照,金黃色葡萄球菌DNA 模板作陰性對照,空白對照加水1 μL。
2.2.5 確證試驗
阪崎腸杆菌PCR 擴增產物為282 bp,如果電泳出現陽性條帶,則取恒溫培養的相應剩餘BHI 增菌液接種於阪崎腸杆菌顯色培基,參照2.1 分離與計數方法,挑取可疑菌落進行鑒定。
3 結果與討論
3.1 分離計數法與普通PCR 法檢測比較
對50 份進口原料乳粉分離計數法和普通PCR法同時比對檢測,以評價兩種方法的符合程度,結果見表2。
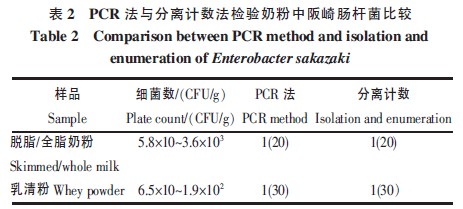
從表2 中可以看出,兩種方法的檢驗結果完全相符,說明兩種方法檢驗奶粉中阪崎腸杆菌結果均準確、可靠。
通過兩種方法比較檢測, 雖然檢測效果相同,但是比較其檢驗流程, 如果樣品為陰性結果,PCR 方法較分離計數法快2 d;如果檢測結果為陽性,PCR 方法較分離計數法可早1 d 得到結果。
同時發現同一標準下不同檢測方法的增菌步驟不盡相同,而且由於PCR 方法陽性結果需要分離計數法確認試驗,以分離到陽性菌株為最終結果,所以統一增菌步驟,建立一套完整的試驗體係,將使試驗設計更為嚴密。
3.2 DNA 提取方法比較
對50 份進口原料乳粉進行普通PCR 法檢測時,DNA 提取同時采用試劑盒、煮沸法兩種方法進行。結果顯示兩種方法對BHI 增菌液進行DNA 提取時,試驗結果完全相同。分析原因,MLST 及BHI 對阪崎腸杆菌增菌效果很好, 當樣品中有阪崎腸杆菌100 CFU/100 g檢測在阪崎腸杆菌試驗中, 取樣量均為3 個100 g。在31 份陽性樣品中,3 個100 g 均驗出阪崎腸杆菌的樣品很少,絕大多數樣品隻在3 個100 g 中驗出其中1份100 g 樣品陽性,說明阪崎腸杆菌在乳粉中含量很少, 如果隻取100 g 樣品進行檢測則容易造成漏檢。Muytjens 等發現,來自35 個國家的141 種嬰兒配方奶粉約14 %含有阪崎腸杆菌,含量從0.36 CFU/100 g 到66.0 CFU/100 g。Nazarowec-White 和Farber 測試了加拿大5 家不同公司的120 罐嬰兒配方奶粉, 發現其中6.7 %含有阪崎腸杆菌,陽性樣品中阪崎腸杆菌的量通常是0.36 CFU/100 g 所以在檢測中取樣量一定要充足,定量檢測取夠333 g,定性檢測取樣量為300 g,才能防止漏檢。尤其是成品嬰幼兒配方粉檢測更應注意, 雖然Nazarwec-White 和Farber 認為1 000 個阪崎腸杆菌/100 g 為感染限量標準比較合理。而Havelaar和Zwietering 認為含有低量阪崎腸杆菌的奶粉溶液在
時經兩步增菌即可到達105 CFU/100 g[4],完全可以達到PCR 檢測要求, 任何一種DNA 提取方法均可滿足要求,但煮沸法更簡單,經濟實惠。
3.3 阪崎腸杆菌陽性統計數據分析
阪崎腸杆菌廣泛存在於環境和各類食品中,如水、溫泉、豆腐、奶酪、鹹肉、蔬菜等食品中及醫院空氣、醫療器械、土壤等環境中[5]。在2005 年開展阪崎腸杆菌檢測方法研究中,從魚粉、狗咬膠及膨化食品中多次驗出阪崎腸杆菌。
統計31 株阪崎腸杆菌的VITEK 生化鑒定報告,見表3。
其中7 個生化試驗結果具有可變性,但與阪崎腸杆菌的檢出地域無關。目前核糖核酸分型及質粒分型已應用於阪崎腸杆菌的分型研究中。該生化試驗資料的積累為阪崎腸杆菌進一步深化研究及生化分型奠定基礎。37 ℃,大約隻要2 h 就能使超過1/1 000 的嬰兒患病,因此嬰兒配方奶粉中阪崎腸杆菌應該不得檢出,要最大限度的防止漏檢的發生。
上一篇:食品工廠微生物學檢驗實驗室的建設

