











1 範圍
本標準規定了食品中大腸菌群( Coliforms)計數的方法。
本標準適用於食品中大腸菌群的計數。
2 術語和定義
2.1 大腸菌群 coliforms
在一定培養條件下能發酵乳糖、產酸產氣的需氧和兼性厭氧革蘭氏陰性無芽胞杆菌。
2.2 最可能數 most probable number,MPN
基於泊鬆分布的一種間接計數方法。
3 檢驗原理
3.1 MPN法
MPN法是統計學和微生物學結合的一種定量檢測法。待測樣品經係列稀釋並培養後,根據其未生長的最低稀釋度與生長的最高稀釋度,應用統計學概率論推算出待測樣品中大腸菌群的最大可能數。
3.2 平板計數法
大腸菌群在固體培養基中發酵乳糖產酸,在指示劑的作用下形成可計數的紅色或紫色,帶有或不帶有沉澱環的菌落。
4 設備和材料
除微生物實驗室常規滅菌及培養設備外,其他設備和材料如下:
4.1 恒溫培養箱: 36 ℃ ±1 ℃。
4.2 冰箱: 2 ℃~5 ℃ 。
4.3 恒溫水浴箱: 46℃±1℃ 。
4.4 天平:感量 0.1 g。
4.5 均質器。
4.6 振蕩器。
4.7 無菌吸管: 1 mL(具 0.01 mL 刻度)、 10 mL(具 0.1 mL 刻度)或微量移液器及吸頭。
4.8 無菌錐形瓶:容量 500 mL。
4.9 無菌培養皿:直徑 90 mm。
4.10 pH 計或 pH 比色管或精密 pH 試紙。
4.11 菌落計數器。
5 培養基和試劑
5.1 月桂基硫酸鹽胰蛋白腖( Lauryl Sulfate Tryptose, LST)肉湯:見附錄 A 中 A.1。
5.2 煌綠乳糖膽鹽( Brilliant Green Lactose Bile, BGLB)肉湯:見附錄 A 中 A.2。
5.3 結晶紫中性紅膽鹽瓊脂( Violet Red Bile Agar, VRBA):見附錄 A 中 A.3。
5.4 磷酸鹽緩衝液:見附錄 A 中 A.4。
5.5 無菌生理鹽水:見附錄 A 中 A.5。
5.6 無菌 1 mol/L NaOH:見附錄 A 中 A.6。
5.7 無菌 1 mol/L HCl:見附錄 A 中 A.7。
第一法 大腸菌群 MPN 計數法
6 檢驗程序
大腸菌群MPN計數的檢驗程序見圖1 。
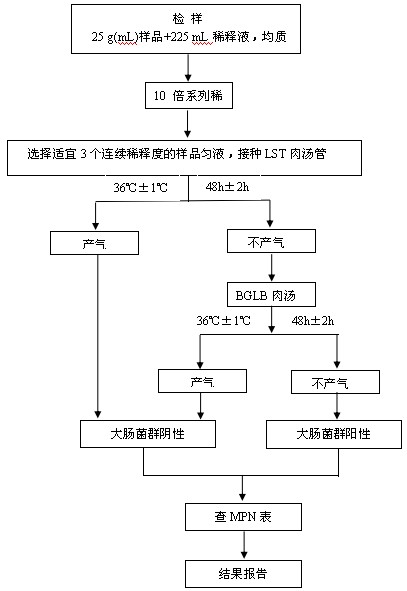
圖1 大腸菌群 MPN 計數法檢驗程序
7 操作步驟
7.1 樣品的稀釋
7.1.1 固體和半固體樣品:稱取 25 g 樣品,放入盛有 225 mL 磷酸鹽緩衝液或生理鹽水的無菌均質杯內 ,8000 r/min~10000 r/min 均質 1 min~2 min,或放入盛有 225 mL 磷酸鹽緩衝液或生理鹽水的無菌均質袋中,用拍擊式均質器以6次/s~9次/s拍打 1 min~2 min,製成 1:10 的樣品勻液。
7.1.2 液體樣品:以無菌吸管吸取 25 mL 樣品置盛有 225 mL 磷酸鹽緩衝液或生理鹽水的無菌錐形瓶(瓶內預置適當數量的無菌玻璃珠)中充分振搖或置於機械振蕩器中振搖,充分混勻,製成 1:10 的樣品勻液。
7.1.3 樣品勻液的 pH 值應在 6.5~7.5 之間,必要時分別用 1 mol/L NaOH 或 1 mol/L HCl 調節。
7.1.4 用 1 mL 無菌吸管或微量移液器吸取 1:10 樣品勻液 1 mL,沿管壁緩緩注入 9 mL 磷酸鹽緩衝液或生理鹽水的無菌試管中(注意吸管或吸頭尖端不要觸及稀釋液麵),振搖試管或換用 1 支 1 mL 無菌吸管反複吹打,使其混合均勻,製成 1:100 的樣品勻液。
7.1.5 根據對樣品汙染狀況的估計,按上述操作,依次製成十倍遞增係列稀釋樣品勻液。每遞增稀釋1 次,換用 1 支1 mL無菌吸管或吸頭。從製備樣品勻液至樣品接種完畢,全過程不得超過15 min。
7.2 初發酵試驗
每個樣品,選擇3個適宜的連續稀釋度的樣品勻液(液體樣品可以選擇原液),每個稀釋度接種3
管月桂基硫酸鹽胰蛋白腖( LST)肉湯,每管接種1mL(如接種量超過1 mL,則用雙料LST肉湯), 36℃ ±1 ℃培養24 h±2 h,觀察倒管內是否有氣泡產生, 24 h±2 h產氣者進行複發酵試驗(證實試驗),如未產氣則繼續培養至48 h±2 h,產氣者進行複發酵試驗。未產氣者為大腸菌群陰性。
7.3 複發酵試驗(證實試驗)
用接種環從產氣的LST肉湯管中分別取培養物1 環, 移種於煌綠乳糖膽鹽肉湯( BGLB) 管中, 36 ℃ ±1℃培養48 h±2 h,觀察產氣情況。產氣者,計為大腸菌群陽性管。
7.4大腸菌群最可能數(MPN)的報告
按7.3確證的大腸菌群LST陽性管數,檢索MPN表(見附錄B),報告每g(mL)樣品中大腸菌群的
MPN值。
第二法 大腸菌群平板計數法
8 檢驗程序
大腸菌群平板計數法的檢驗程序見圖2。
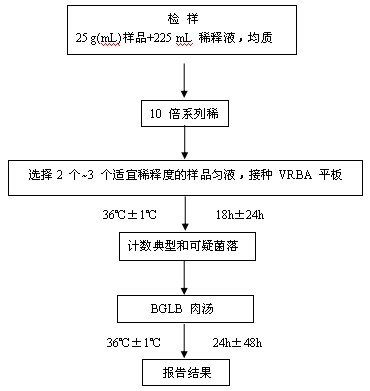
圖2 大腸菌群平板計數法檢驗程序
9 操作步驟
9.1 樣品的稀釋
按7.1進行。
9.2 平板計數
9.2.1 選取2個~3個適宜的連續稀釋度, 每個稀釋度接種2個無菌平皿,每皿1 mL。同時取1 mL生理鹽水加入無菌平皿作空白對照。
9.2.2 及時將15 mL~20 mL冷至46 ℃的結晶紫中性紅膽鹽瓊脂( VRBA)約傾注於每個平皿中。小心旋轉平皿,將培養基與樣液充分混勻,待瓊脂凝固後,再加3 mL~4 mLVRBA覆蓋平板表層。翻轉平板,置於36 ℃ ±1 ℃培養18 h~24 h。
8.3 平板菌落數的選擇
選取菌落數在 15 CFU~150 CFU 之間的平板,分別計數平板上出現的典型和可疑大腸菌群菌落(如菌落直徑較典型菌落小)。典型菌落為紫紅色,菌落周圍有紅色的膽鹽沉澱環,菌落直徑為 0.5 mm 或更大。
9.4 證實試驗
從 VRBA 平板上挑取 10 個不同類型的典型和可疑菌落,分別移種於 BGLB 肉湯管內, 36 ℃ ±1 ℃培養 24 h~48 h,觀察產氣情況。凡 BGLB 肉湯管產氣,即可報告為大腸菌群陽性。
9.5 大腸菌群平板計數的報告
經最後證實為大腸菌群陽性的試管比例乘以9.3中計數的平板菌落數,再乘以稀釋倍數,即為每g
( mL)樣品中大腸菌群數。例: 10-4樣品稀釋液1 mL,在VRBA平板上有100個典型和可疑菌落,挑取其中10個接種BGLB肉湯管,證實有6個陽性管,則該樣品的大腸菌群數為: 100×6/10×104/g( mL)=6.0×105CFU/g( mL)。
附 錄A
培養基和試劑
A.1 月桂基硫酸鹽胰蛋白腖(LST)肉湯
A.1.1 成分
胰蛋白腖或胰酪腖 20.0 g
氯化鈉 5.0 g
乳糖 5.0 g
磷酸氫二鉀(K2HPO4) 2.75 g
磷酸二氫鉀( KH2PO4) 2.75 g
月桂基硫酸鈉 0.1 g
蒸餾水 1 000 mL
pH 6.8±0.2
A.1.2 製法
將上述成分溶解於蒸餾水中,調節 pH。分裝到有玻璃小倒管的試管中,每管 10 mL。 121 ℃高壓滅菌 15 min。
A.2 煌綠乳糖膽鹽(BGLB)肉湯
A.2.1 成分
蛋白腖 10.0 g
乳糖 10.0 g
牛膽粉( oxgall或oxbile)溶液 200 mL
0.1%煌綠水溶液 13.3 mL
蒸餾水 800 mL
pH 7.2±0.1
A.2.2 製法
將蛋白腖、乳糖溶於約500 mL蒸餾水中,加入牛膽粉溶液200 mL(將20.0 g脫水牛膽粉溶於200 mL蒸餾水中,調節pH至7.0~7.5),用蒸餾水稀釋到975 mL,調節pH,再加入0.1%煌綠水溶液13.3 mL,用蒸餾水補足到1 000 mL,用棉花過濾後,分裝到有玻璃小倒管的試管中,每管10 mL。 121 ℃高壓滅菌15 min。
A.3 結晶紫中性紅膽鹽瓊脂(VRBA)
A.3.1 成分
蛋白腖 7.0 g
酵母膏 3.0 g
乳糖 10.0 g
氯化鈉 5.0 g
膽鹽或3號膽鹽 1.5 g
中性紅 0.03 g
結晶紫 0.002 g
瓊脂 15 g~18 g
蒸餾水 1 000 mL
pH 7.4±0.1
A.3.2 製法
將上述成分溶於蒸餾水中,靜置幾分鍾,充分攪拌,調節pH。煮沸2 min,將培養基冷卻至45 ℃~
50 ℃傾注平板。使用前臨時製備,不得超過3 h。
A.4 磷酸鹽緩衝液
A.4.1 成分
磷酸二氫鉀( KH2PO4) 34.0 g
蒸餾水 500 mL
pH 7.2
A.4.2 製法
貯存液:稱取34.0 g的磷酸二氫鉀溶於500 mL蒸餾水中,用大約175 mL的1 mol/L氫氧化鈉溶液調節pH,用蒸餾水稀釋至1 000 mL後貯存於冰箱。稀釋液:取貯存液1.25 mL,用蒸餾水稀釋至1 000 mL,分裝於適宜容器中, 121 ℃高壓滅菌15 min。
A.5 無菌生理鹽水
A.5.1 成分
氯化鈉 8.5 g
蒸餾水 1000 mL
A.5.2 製法
稱取8.5g氯化鈉溶於1000 mL蒸餾水中, 121 ℃高壓滅菌15 min。
A.6 1 mol/L NaOH
A.6.1 成分
NaOH 40.0 g
蒸餾水 1000 mL
A.6.2 製法
稱取40 g氫氧化鈉溶於1000 mL蒸餾水中, 121 ℃高壓滅菌15 min。
A.7 1 mol/L HCl
A.7.1 成分
HCl 90 mL
蒸餾水 1000 mL
A.7.2 製法
移取濃鹽酸90 mL,用蒸餾水稀釋至1000 mL, 121 ℃高壓滅菌15 min。
附 錄B
大腸菌群最可能數(MPN)檢索表
B.1大腸菌群最可能數(MPN)檢索表
每g(mL)檢樣中大腸菌群最可能數(MPN)的檢索見表B.1。
表B.1 大腸菌群最可能數(MPN)檢索表
|
陽性管數 |
MPN |
95%可信限 |
陽性管數 |
MPN |
95%可信限 |
||||||
|
0.10 |
0.01 |
0.001 |
下限 |
上線 |
0.10 |
0.01 |
0.001 |
下限 |
上限 |
||
|
0 |
0 |
0 |
<3.0 |
-- |
9.5 |
2 |
2 |
0 |
21 |
4.5 |
42 |
|
0 |
0 |
1 |
3.0 |
0.15 |
9.6 |
2 |
2 |
1 |
28 |
8.7 |
94 |
|
0 |
1 |
0 |
3.0 |
0.15 |
11 |
2 |
2 |
2 |
35 |
8.7 |
94 |
|
0 |
1 |
1 |
6.1 |
1.2 |
18 |
2 |
3 |
0 |
29 |
8.7 |
94 |
|
0 |
2 |
0 |
6.2 |
1.2 |
18 |
2 |
3 |
1 |
36 |
8.7 |
94 |
|
0 |
3 |
0 |
9.4 |
3.6 |
38 |
3 |
0 |
0 |
23 |
4.6 |
94 |
|
1 |
0 |
0 |
3.6 |
0.17 |
18 |
3 |
0 |
1 |
38 |
8.7 |
110 |
|
1 |
0 |
1 |
7.2 |
1.3 |
18 |
3 |
0 |
2 |
64 |
17 |
180 |
|
1 |
0 |
2 |
11 |
3.6 |
38 |
3 |
1 |
0 |
43 |
9 |
180 |
|
1 |
1 |
0 |
7.4 |
1.3 |
20 |
3 |
1 |
1 |
75 |
17 |
200 |
|
1 |
1 |
1 |
11 |
3.6 |
38 |
3 |
1 |
2 |
120 |
37 |
420 |
|
1 |
2 |
0 |
11 |
3.6 |
42 |
3 |
1 |
3 |
160 |
40 |
420 |
|
1 |
2 |
1 |
15 |
4.5 |
42 |
3 |
2 |
0 |
93 |
18 |
420 |
|
1 |
3 |
0 |
16 |
4.5 |
42 |
3 |
2 |
1 |
150 |
37 |
420 |
|
2 |
0 |
0 |
9.2 |
1.4 |
38 |
3 |
2 |
2 |
210 |
40 |
430 |
|
2 |
0 |
1 |
14 |
3.6 |
42 |
3 |
2 |
3 |
290 |
90 |
1000 |
|
2 |
0 |
2 |
20 |
4.5 |
42 |
3 |
3 |
0 |
240 |
42 |
1000 |
|
2 |
1 |
0 |
15 |
3.7 |
42 |
3 |
3 |
1 |
460 |
90 |
2000 |
|
2 |
1 |
1 |
20 |
4.5 |
42 |
3 |
3 |
2 |
1100 |
180 |
4100 |
|
2 |
1 |
2 |
27 |
8.7 |
94 |
3 |
3 |
3 |
>1100 |
420 |
-- |
|
注1:本表采用3個稀釋度[0.1g(mL)、0.01g(mL)、0.001g(mL)],每個稀釋度接種3管。 注2:表內所列檢樣量如改用1g(mL)、0.1g(mL)和0.01g(mL)時,表內數字應相應降低10倍;如改用0.01g(mL)、0.001g(mL)和0.00001g(mL)時,則表內數字應相應增高10倍,其餘類推。 |
|||||||||||
![]()
下一篇:食品微生物學檢驗 沙門氏菌檢驗

