











1. 範圍
本標準規定了食品中單核細胞增生李斯特氏菌(Listeria monocytogenes)的檢驗方法。
本標準第一法適用於食品中單核細胞增生李斯特氏菌的定性檢驗;第二法適用於單核細胞
增生李斯特氏菌含量較高的食品中單核細胞增生李斯特氏菌的計數;第三法適用於單核細胞增
生李斯特氏菌含量較低而雜菌含量較高的食品中單核細胞增生李斯特氏菌的計數。
2. 設備和材料
注: 除微生物實驗室常規滅菌及培養設備外,其他設備和材料如下:
2.1 冰箱:2 ℃~5 ℃。
2.2 恒溫培養箱:30 ℃±1 ℃、36 ℃±1 ℃、20 ℃±1 ℃。
2.3 均質器。
2.4 顯微鏡:10倍~100倍。
2.5 電子天平:感量0.1 g 。
2.6 錐形瓶:100 mL、500 mL。
2.7 無菌吸管:1 mL(具0.01 mL刻度)、10 mL(具0.1 mL刻度)或微量移液器及吸頭。
2.8 無菌平皿:直徑90 mm。
2.9 無菌試管:16 mm×160 mm。
2.10 離心管:30 mm×100 mm。
2.11 無菌注射器:1 mL。
2.12 單核細胞增生李斯特氏菌(Listeria monocytogenes ATCC19111或CMCC54004)、英諾克
李斯特氏菌(Listeria innocua ATCC33090)、伊氏李斯特氏菌(Listeria ivanovii ATCC19119)、斯氏李斯特氏菌(Listeria seeligeri ATCC35967)或具相同效果的標準株。
2.13 金黃色葡萄球菌(Staphylococcus aureus ATCC25923或其他產β-溶血環金葡菌)。
2.14 馬紅球菌(Rhodococcus equi ATCC6939或NCTC1621)。
2.15 小白鼠:ICR體重18 g~22 g。
2.16 全自動微生物生化鑒定係統。
3 培養基和試劑
3.1 含0.6%酵母浸膏的胰酪腖大豆肉湯(TSB-YE):見附錄A中A.1。
3.2 含0.6%酵母浸膏的胰酪腖大豆瓊脂(TSA-YE):見附錄A中A.2。
3.3 李氏增菌肉湯LB(LB1,LB2):見附錄A中A.3。
3.4 1%鹽酸吖啶黃(acriflavine HCl)溶液:見附錄A中A.3.2.1、A.3.2.2。
3.5 1%萘啶酮酸鈉鹽(naladixic acid)溶液:見附錄A中A.3.2.1、A.3.2.2。
3.6 PALCAM瓊脂:見附錄A中A.4。
3.7 ALOA (Agar Listeria according to Ottaviani and Agosti)瓊脂:見附錄A中A.5。
3.8 革蘭氏染液:見附錄A中A.6。
3.9 SIM動力培養基:見附錄A中A.7。
3.10 緩衝葡萄糖蛋白腖水[甲基紅(MR)和V-P試驗用]:見附錄A中A.8。
3.11 5%~8%羊血瓊脂:見附錄A中A.9。
3.12 糖發酵管:見附錄A中A.10。
3.13 過氧化氫試劑:見附錄A中A.11。
3.14 李斯特氏菌顯色培養基。
3.15 生化鑒定試劑盒或全自動微生物鑒定係統。
3.16 緩衝蛋白凍水:見附錄A中A.12
第一法 單核細胞增生李斯特氏菌定性檢驗
4. 檢驗程序
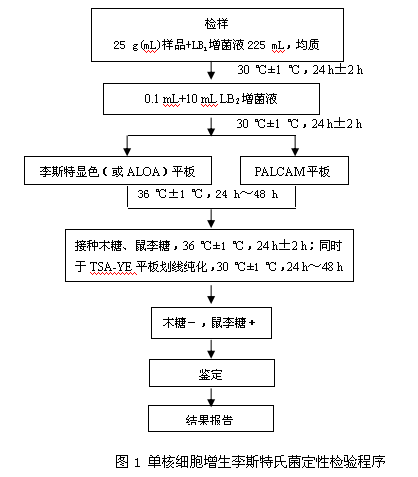
單核細胞增生李斯特氏菌定性檢驗程序見圖1。
5 操作步驟
5.1 增菌
以無菌操作取樣品25 g(mL)加入到含有225 mL LB1增菌液的均質袋中,在拍擊式均質器上連續均質1 min~2 min;或放入盛有225 mL LB1增菌液的均質杯中,以8000 r/min~10000 r/min均質1 min~2 min。於30 ℃±1 ℃培養24 h±2 h,移取0.1 mL,轉種於10 mL LB2增菌液內,於30 ℃±1 ℃培養18 h~24 h。
5.2 分離
取LB2 二次增菌液劃線接種於李斯特氏菌顯色(或ALOA)平板和PALCAM瓊脂平板,於36 ℃±1 ℃培養24 h~48 h,觀察各個平板上生長的菌落。典型菌落在ALOA瓊脂平板上為藍綠色菌落周圍有不透明暈圈;在PALCAM瓊脂平板上為小的圓形灰綠色菌落,周圍有棕黑色水解圈,有些菌落有黑色凹陷;在李斯特氏菌顯色平板上的菌落特征,參照產品說明進行判定。
注: ALOA平板上的典型菌落為單核細胞增生李斯特氏菌或伊氏李斯特氏菌;如果ALOA平板上菌落不典型,可繼續培養48 h,再觀察。部分菌株不產生透明暈圈。
5.3 初篩
自選擇性瓊脂平板上分別挑取3個~5個典型或可疑菌落,在TSA-YE平板上劃線純化, 於36 ℃±1 ℃培養18 h~24 h,分別接種在木糖、鼠李糖發酵管,於36 ℃±1 ℃培養24 h±2 h。選擇木糖陰性、鼠李糖陽性的純培養物繼續進行鑒定。
5.4 鑒定
5.4.1 染色鏡檢:李斯特氏菌為革蘭氏陽性短杆菌,大小為(0.4 μm~0.5 μm)×(0.5 μm~2.0 μm);用生理鹽水製成菌懸液,在油鏡或相差顯微鏡下觀察,該菌出現輕微旋轉或翻滾樣的運動。
5.4.2 動力試驗:挑取純培養的單個可疑菌落穿刺半固體或SIM動力培養基,於25℃~30℃培養48h,李斯特氏菌有動力,在半固體或SIM培養基上方呈傘狀生長,如傘狀生長不明顯,可繼續培養5d,再觀察結果。
5.4.3 生化鑒定:挑取純培養的單個可疑菌落,進行過氧化氫酶試驗,過氧化氫酶陽性反應的菌落繼續進行糖發酵試驗和MR-VP試驗。單核細胞增生李斯特氏菌的主要生化特征見表1。
5.4.4 溶血試驗:將新鮮的羊血瓊脂平板底麵劃分為20個~25個小格,挑取純培養的單個可疑菌落刺種到血平板上,每格刺種一個菌落,並刺種陽性對照菌(單增李斯特氏菌、伊氏李斯特氏菌和斯氏李斯特氏菌)和陰性對照菌(英諾克李斯特氏菌),穿刺時盡量接近底部,但不要觸到底麵,同時避免瓊脂破裂,36 ℃±1 ℃培養24 h~48 h,於明亮處觀察,單增李斯特氏菌呈現狹窄、清晰、明亮的溶血圈,斯氏李斯特氏菌在刺種點周圍產生弱的透明溶血圈,英諾克李斯特氏菌無溶血圈,伊氏李斯特氏菌產生寬的、輪廓清晰的β-溶血區域,若結果不明顯,可置4℃冰箱24 h~48 h再觀察。
注:也可用劃線接種法。
5.4.5 協同溶血試驗 cAMP(可選項目):在羊血瓊脂平板上平行劃線接種金黃色葡萄球菌和馬紅球菌,挑取純培養的單個可疑菌落垂直劃線接種於平行線之間,垂直線兩端不要觸及平行線,距離1mm~2mm,同時接種單核細胞增生李斯特氏菌、英諾克李斯特氏菌、伊氏李斯特氏菌和斯氏李斯特氏菌,於36 ℃±1 ℃培養24 h~48 h。單核細胞增生李斯特氏菌在靠近金黃色葡萄球菌處出現約2mm的β-溶血增強區域,斯氏李斯特氏菌也出現微弱的溶血增強區域,伊氏李斯特氏菌在靠近馬紅球菌處出現約5mm~10mm的“箭頭狀”β-溶血增強區域,英諾克李斯特氏菌不產生溶血現象。若結果不明顯,可置4℃冰箱24 h~48 h再觀察。
5.5 可選擇生化鑒定試劑盒或全自動微生物鑒定係統等對木糖陰性、鼠李糖陽性的純培養物進行鑒定。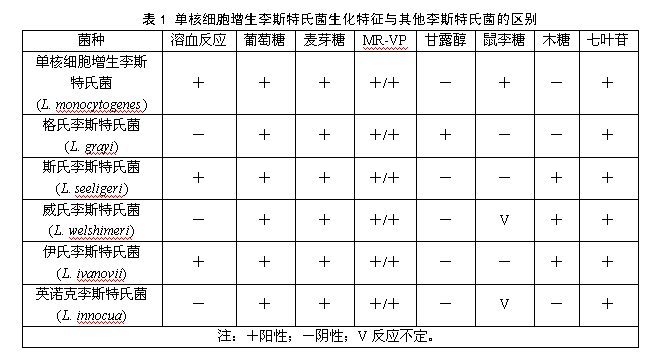
5.6 小鼠毒力試驗(可選項目)
將符合上述特性的純培養物接種於TSB-YE中,於36 ℃±1 ℃培養24 h,4 000 r/min離心5 min,棄上清液,用無菌生理鹽水製備成濃度為1010 CFU/mL的菌懸液,取此菌懸液對3隻~5隻小鼠進行腹腔注射,每隻0.5 mL,同時觀察小鼠死亡情況。接種致病株的小鼠於2 d~5 d內死亡。試驗設單增李斯特氏菌致病株和滅菌生理鹽水對照組。單核細胞增生李斯特氏菌、伊氏李斯特氏菌對小鼠有致病性。
5.7 結果與報告
綜合以上生化試驗和溶血試驗的結果,報告25 g(mL)樣品中檢出或未檢出單核細胞增生李斯特氏菌。
上一篇:B群鏈球菌的臨床意義有哪些?

