











前 言
本標準代替GB/T4789.8—2008《食品衛生微生物學檢驗 小腸結腸炎耶爾森氏菌檢驗》。
本標準與GB/T4789.8—2008相比,主要變化如下:
———標準名稱修改為“食品安全國家標準 食品微生物學檢驗 小腸結腸炎耶爾森氏菌檢驗”;
———修改了典型菌落的形態描述;
———刪除了生化鑒定中的商品化名稱;
———描述了血清鑒定的方法。
1 範圍
本標準規定了食品中小腸結腸炎耶爾森氏菌(Yersiniaenterocolitica)的檢驗方法。
本標準適用於食品中小腸結腸炎耶爾森氏菌的檢驗。
2 設備和材料
除微生物實驗室常規滅菌及培養設備外,其他設備和材料如下:
2.1 冰箱:0℃~4℃。
2.2 恒溫培養箱:26℃±1℃、36℃±1℃。
2.3 顯微鏡:10倍~100倍。
2.4 均質器。
2.5 天平:感量0.1g。
2.6 滅菌試管:16mm×160mm、15mm×100mm。
2.7 滅菌吸管:1mL (具0.01mL刻度)、10mL (具0.1mL刻度)。
2.8 錐形瓶:200mL、500mL。
2.9 滅菌平皿:直徑90mm。
2.10 微生物生化鑒定試劑盒或微生物生化鑒定係統。
3 培養基和試劑
3.1 改良磷酸鹽緩衝液:見A.1。
3.2 CIN-1培養基(CepulodinIrgasanNovobiocinAgar):見A.2。
3.3 改良Y培養基(AgarY,Modified):見A.3。
3.4 改良克氏雙糖培養基:見A.4。
3.5 糖發酵管:見A.5。
3.6 鳥氨酸脫羧酶試驗培養基:見A.6。
3.7 半固體瓊脂:見A.7。
3.8 緩衝葡萄糖蛋白腖水[甲基紅(MR)和V-P試驗用]:見A.8。
3.9 堿處理液:見A.9。
3.10 尿素培養基:見A.10。
3.11 營養瓊脂:見A.11。
3.12 小腸結腸炎耶爾森氏菌診斷血清。
4 檢驗程序
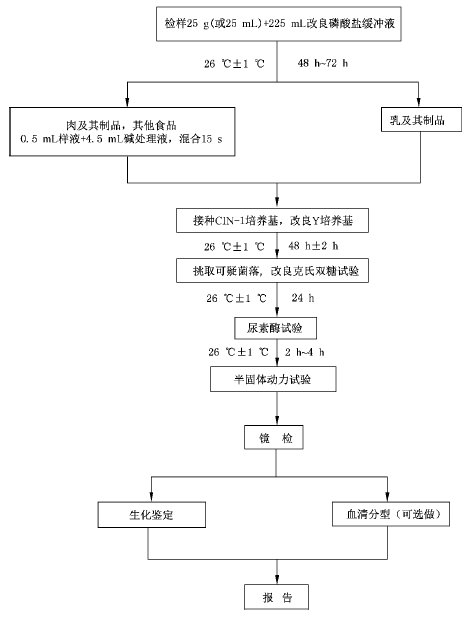
小腸結腸炎耶爾森氏菌檢驗程序見圖1。
5 操作步驟
5.1 增菌
以無菌操作取25g(或25mL)樣品放入含有225mL改良磷酸鹽緩衝液增菌液的無菌均質杯或均質袋內,以8000r/min均質1min或拍擊式均質器均質1min。液體樣品或粉末狀樣品,應振蕩混勻。均質後於26℃±1℃增菌48h~72h。增菌時間長短可根據對樣品汙染程度的估計來確定。
5.2 堿處理
除乳與乳製品外,其他食品的增菌液0.5mL與堿處理液4.5mL充分混合15s。
5.3 分離
將乳與乳製品增菌液或經過堿處理的其他食品增菌液分別接種於CIN-1瓊脂平板和改良Y 瓊脂平板,26℃±1℃培養48h±2h。典型菌落在CIN-1上為深紅色中心,周圍具有無色透明圈(紅色牛眼狀菌落),菌落大小為1mm~2mm,在改良Y瓊脂平板上為無色透明、不黏稠的菌落。
5.4 改良克氏雙糖試驗
分別挑取5.3中的可疑菌落3個~5個,分別接種於改良克氏雙糖鐵瓊脂,接種時先在斜麵劃線,再於底層穿刺,26℃±1℃培養24h,將斜麵和底部皆變黃且不產氣的培養物做進一步的生化鑒定。
5.5 尿素酶試驗和動力觀察
用接種環挑取一滿環5.4得到的可疑培養物,接種到尿素培養基中,接種量應足夠大,振搖幾秒鍾,26℃±1℃培養2h~4h。將尿素酶試驗陽性菌落分別接種於兩管半固體培養基中,於26℃±1℃和36℃±1℃培養24h。將在26℃有動力而36℃無動力的可疑菌培養物劃線接種營養瓊脂平板,進行純化培養,用純化物進行革蘭氏染色鏡檢和生化試驗。
5.6 革蘭氏染色鏡檢
將純化的可疑菌進行革蘭染色。小腸結腸炎耶爾森氏菌呈革蘭氏陰性球杆菌,有時呈橢圓或杆狀,大小為(0.8μm~3.0μm)×0.8μm
5.7 生化鑒定
5.7.1 從5.5中的營養瓊脂平板上挑取單個菌落接種生化反應管,生化反應在26℃±1℃進行。小腸結腸炎耶爾森氏菌的主要生化特征以及與其他相似菌的區別見表1。

5.7.2 如選擇微生物生化鑒定試劑盒或微生物生化鑒定係統,可根據5.6鏡檢結果,選擇革蘭陰性球杆菌菌落作為可疑菌落,從5.5所接種的營養瓊脂平板上挑取單菌落,使用微生物生化鑒定試劑盒或微生物生化鑒定係統進行鑒定。
5.8 血清型鑒定(選做項目)
除進行生化鑒定外,可選擇做血清型鑒定。在潔淨的載玻片上加一滴O 因子血清,將待試培養物混入其內,使成為均一性混濁懸液,將玻片輕輕搖動0.5min~1min,在黑色背景下觀察反應。如在2min內出現比較明顯的小顆粒狀凝集者,即為陽性反應,反之則為陰性,另用生理鹽水作對照試驗,以檢查有無自凝現象;具體操作方法可按GB4789.4中沙門氏菌O 因子血清分型方法進行。
6 結果與報告
綜合以上及生化特征報告結果,報告25g(或25mL)樣品中檢出或未檢出小腸結腸炎耶爾森氏菌。
附 錄 A
培養基和試劑
A.1 改良磷酸鹽緩衝液
A.1.1 成分
磷酸氫二鈉 8.23g
磷酸二氫鈉1.2g
氯化鈉5.0g
三號膽鹽1.5g
山梨醇20.0g
A.1.2 製法
將磷酸鹽及氯化鈉溶於蒸餾水中,再加入三號膽鹽及山梨醇,溶解後校正pH 至7.6,分裝試管,於121℃高壓滅菌15min,備用。
A.2 CIN-1培養基
A.2.1 基礎培養基:
胰腖20.0g
酵母浸膏2.0g
甘露醇20.0g
氯化鈉1.0g
去氧膽酸鈉2.0g
硫酸鎂0.01g
瓊脂12.0g
蒸餾水950mL
校正pH 至7.5±0.1,將基礎培養基於121℃高壓滅菌15min,備用。
A.2.2 Irgasan(二氯苯氧氯酚):可用95% 的乙醇作溶劑,溶解二苯醚,配成0.4% 的溶液來替代Irgasan,待基礎培養基冷至80℃時,加入1mL混勻。
A.2.3 冷至50℃時,加入:
中性紅(3.0mg/mL) 10.0mL
結晶紫(0.1mg/mL) 10.0mL
頭孢菌素(1.5mg/mL) 10.0mL
新生黴素(0.25mg/mL) 10.0mL
最後不斷攪拌加入10.0mL的10%氯化鍶,傾注平皿。
A.3 改良Y 培養基
A.3.1 成分
蛋白腖15.0g
氯化鈉5.0g
乳糖10.0g
草酸鈉2.0g
去氧膽酸鈉6.0g
三號膽鹽5.0g
丙酮酸鈉2.0g
孟加拉紅40.0mg
水解酪蛋白5.0g
瓊脂17.0g
蒸餾水1000mL
A.3.2 製法
將A.3.1中成分混合,校正pH 至7.4±0.1。於121℃高壓滅菌15min,待冷至45℃左右時,傾注平皿。
A.4 改良克氏雙糖培養基
A.4.1 成分
蛋白腖20.0g
牛肉膏3.0g
酵母膏3.0g
山梨醇20.0g
葡萄糖1.0g
氯化鈉5.0g
檸檬酸鐵銨0.5g
硫代硫酸鈉0.5g
瓊脂12.0g
酚紅0.025g
蒸餾水1000mL
A.4.2 製法
將酚紅以外的各成分溶解於蒸餾水中,校正pH 至7.4。加入0.2%的酚紅溶液12.5mL,搖勻,分裝試管,裝量宜多些,以便得到比較高的底層。121℃高壓滅菌15min,放置高層斜麵備用。
A.5 糖發酵管
A.5.1 成分
牛肉膏5.0g
蛋白腖10.0g
氯化鈉3.0g
磷酸氫二鈉2.0g
0.2%溴麝香草酚藍溶液12.0mL
蒸餾水1000mL
A.5.2 製法
A.5.2.1 葡萄糖發酵管按A.5.1中成分配好後,校正pH 至7.4,按0.5%加入葡萄糖,分裝於有一個倒置小管的小試管內,121℃高壓滅菌15min。
A.5.2.2 其他各種糖發酵管可按上述成分配好後,分裝每瓶100mL,121℃高壓滅菌15min。另將各種糖類分別配好10%溶液,同時高壓滅菌。將5mL糖溶液加入100mL培養基內,以無菌操作分裝小試管。蔗糖不純,加熱後會自行水解者,應采用過濾法除菌。
A.5.3 試驗方法
從瓊脂斜麵上挑取少量培養物接種於26 ℃±1 ℃培養,一般觀察2d~3d。遲緩反應需觀察14d~30d。
A.6 鳥氨酸脫羧酶試驗培養基
A.6.1 成分
蛋白腖5.0g
酵母浸膏3.0g
葡萄糖1.0g
蒸餾水1000mL
1.6%溴甲酚紫-乙醇溶液1.0mL
L-鳥氨酸或DL-鳥氨酸0.5g/100mL或1g/100mL
A.6.2 製法
除鳥氨酸以外的成分加熱溶解後,分裝,每瓶100mL,分別加入鳥氨酸。L-鳥氨酸按0.5%加入,DL-鳥氨酸按1%加入。再校正pH 至6.8。對照培養基不加鳥氨酸。分裝於無菌的小試管內,每管0.5mL,上麵滴加一層液體石蠟,115℃高壓滅菌10min。
A.6.3 試驗方法
從瓊脂斜麵上挑取培養物接種,於26℃±1 ℃培養18h~24h,觀察結果。鳥氨酸脫羧酶陽性者由於產堿,培養基呈紫色。陰性者無堿性產物,但因葡萄糖產酸而使培養基變為黃色。對照管為黃色。
A.7 半固體瓊脂
A.7.1 成分
蛋白腖1.0g
牛肉膏0.3g
氯化鈉0.5g
瓊脂0.35g~0.4g
蒸餾水100mL
A.7.2 製法
將A.7.1中成分配好,煮沸使溶解,並校正pH 至7.4。分裝小試管,121 ℃高壓滅菌15min,直立凝固備用。
注:供動力觀察、菌種保存、H 抗原位相變異試驗等用。
A.8 緩衝葡萄糖蛋白腖水[甲基紅(MR)和V-P試驗用]
A.8.1 成分
磷酸氫二鉀5.0g
多腖7.0g
葡萄糖5.0g
蒸餾水1000mL
A.8.2 製法
溶化後校正pH 至7.0,分裝試管,每管1mL,121℃高壓滅菌15min。
A.8.3 甲基紅(MR)試驗
自瓊脂斜麵挑取少量培養物接種本培養基中,於26 ℃±1 ℃培養2d~5d,哈夫尼亞菌則應在22℃~25℃培養。滴加甲基紅試劑一滴,立即觀察結果。鮮紅色為陽性,黃色為陰性。甲基紅試劑配法:10mg甲基紅溶於30mL95%乙醇中,然後加入20mL蒸餾水。
A.8.4 V-P試驗
用瓊脂培養物接種本培養基中,於26℃±1℃培養2d~4d。哈夫尼亞菌則應在22℃~25℃培養。加入6%α-萘酚-乙醇溶液0.5mL和40%氫氧化鉀溶液0.2mL,充分振搖試管,觀察結果。陽性反應立刻或於數分鍾內出現紅色,如為陰性,應放在36℃±1℃培養4h再進行觀察。
A.9 堿處理液
A.9.1 0.5%氯化鈉溶液
氯化鈉0.5g
蒸餾水100mL
121℃高壓滅菌15min。
A.9.2 0.5%氫氧化鉀溶液
氫氧化鉀0.5g
蒸餾水100mL
121℃高壓滅菌15min。
A.9.3 製法
將0.5%氯化鈉及0.5%氫氧化鉀等量混合。
A.10 尿素培養基
A.10.1 成分
尿素20.0g
酵母浸膏0.1g
磷酸二氫鉀0.091g
磷酸氫二鈉0.095g
酚紅0.01g
蒸餾水1000mL
A.10.2 製法
將A.10.1中成分於蒸餾水中溶解,校正pH 至6.8±0.2。不要加熱,過濾除菌,無菌分裝於滅菌小試管中,每管約為3mL。
A.10.3 試驗方法
挑取瓊脂培養物接種在尿素培養基,26℃±1℃培養24h。尿素酶陽性者由於產堿而使培養基變為紅色。
A.11 營養瓊脂
A.11.1 成分
蛋白腖10.0g
牛肉浸膏3g
氯化鈉5g
瓊脂15g
蒸餾水1000mL
A.11.2 製法
將A.11.1中成分於蒸餾水中溶解,校正pH 至7.3±0.2。121℃高壓滅菌15min。

