











前 言
本標準代替GB/T4789.12—2003《食品衛生微生物學檢驗 肉毒梭菌及肉毒毒素檢驗》。
本標準與GB/T4789.12—2003相比,主要變化如下:
———標準名稱修改為“食品安全國家標準 食品微生物學檢驗 肉毒梭菌及肉毒毒素檢驗”;
———增加了PCR鑒定方法;
———增加了結果與報告;
———增加了附錄A;
———修改了設備和材料;
———修改了培養基和試劑;
———修改了檢驗程序;
———規範了樣品製備過程;
———修改了操作步驟中增菌和分離培養部分試驗方法。
1 範圍
本標準規定了食品中肉毒梭菌(Clostridium botulinum )及肉毒毒素(botulinumtoxin)的檢驗方法。
本標準適用於食品中肉毒梭菌及肉毒毒素的檢驗。
2 設備和材料
除微生物實驗室常規滅菌及培養設備外,其他設備和材料如下:
2.1 冰箱:2℃~5℃、-20℃。
2.2 天平:感量0.1g。
2.3 無菌手術剪、鑷子、試劑勺。
2.4 均質器或無菌乳缽。
2.5 離心機:3000r/min、14000r/min。
2.6 厭氧培養裝置。
2.7 恒溫培養箱:35℃±1℃、28℃±1℃。
2.8 恒溫水浴箱:37℃±1℃、60℃±1℃、80℃±1℃。
2.9 顯微鏡:10倍~100倍。
2.10 PCR儀。
2.11 電泳儀或毛細管電泳儀。
2.12 凝膠成像係統或紫外檢測儀。
2.13 核酸蛋白分析儀或紫外分光光度計。
2.14 可調微量移液器:0.2μL~2μL、2μL~20μL、20μL~200μL、100μL~1000μL。
2.15 無菌吸管:1.0mL、10.0mL、25.0mL。
2.16 無菌錐形瓶:100mL。
2.17 培養皿:直徑90mm。
2.18 離心管:50mL、1.5mL。
2.19 PCR反應管。
2.20 無菌注射器:1.0mL。
2.21 小鼠:15g~20g,每一批次試驗應使用同一品係的KM 或ICR小鼠。
3 培養基和試劑
除另有規定外,PCR試驗所用試劑為分析純或符合生化試劑標準,水應符合GB/T6682中一級水的要求。
3.1 庖肉培養基:見A.1。
3.2 胰蛋白酶胰蛋白腖葡萄糖酵母膏肉湯(TPGYT):見A.2。
3.3 卵黃瓊脂培養基:見A.3。
3.4 明膠磷酸鹽緩衝液:見A.4。
3.5 革蘭氏染色液:見A.5。
3.6 10%胰蛋白酶溶液:見A.6。
3.7 磷酸鹽緩衝液(PBS):見A.7。
3.8 1mol/L氫氧化鈉溶液。
3.9 1mol/L鹽酸溶液。
3.10 肉毒毒素診斷血清。
3.11 無水乙醇和95%乙醇。
3.12 10mg/mL溶菌酶溶液。
3.13 10mg/mL蛋白酶K溶液。
3.14 3mol/L 乙酸鈉溶液(pH5.2)。
3.15 TE緩衝液。
3.16 引物:根據表1中序列合成,臨用時用超純水配製引物濃度為10μmol/L。
3.17 10×PCR緩衝液。
3.18 25mmol/L MgCl2。
3.19 dNTPs:dATP、dTTP、dCTP、dGTP。
3.20 Taq 酶。
3.21 瓊脂糖:電泳級。
3.22 溴化乙錠或Goldview。
3.23 5×TBE緩衝液。
3.24 6×加樣緩衝液。
3.25 DNA 分子量標準。
4 檢驗程序
肉毒梭菌及肉毒毒素檢驗程序見圖1。
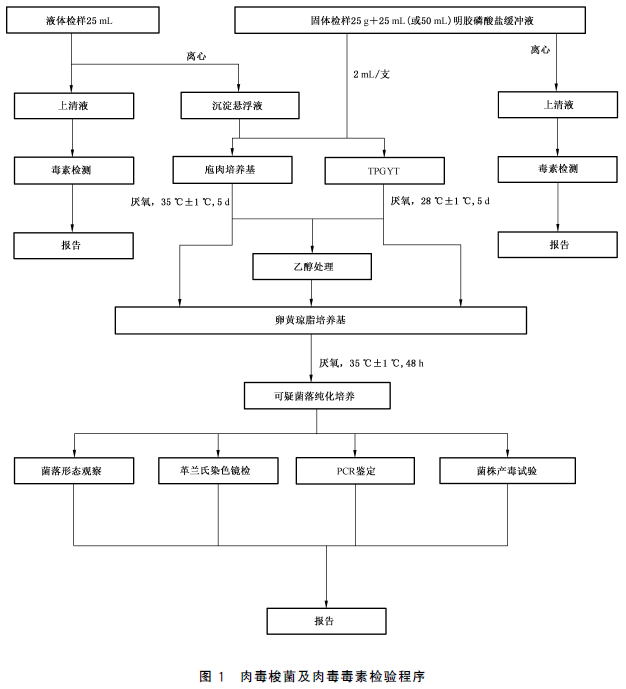
5 操作步驟
5.1 樣品製備
5.1.1 樣品保存
待檢樣品應放置2℃~5℃冰箱冷藏。
5.1.2 固態與半固態食品
固體或遊離液體很少的半固態食品,以無菌操作稱取樣品25g,放入無菌均質袋或無菌乳缽,塊狀食品以無菌操作切碎,含水量較高的固態食品加入25mL明膠磷酸鹽緩衝液,乳粉、牛肉幹等含水量低的食品加入50mL明膠磷酸鹽緩衝液,浸泡30min,用拍擊式均質器拍打2min或用無菌研杵研磨製備樣品勻液,收集備用。
5.1.3 液態食品
液態食品搖勻,以無菌操作量取25mL檢驗。
5.1.4 剩餘樣品處理
取樣後的剩餘樣品放2℃~5℃冰箱冷藏,直至檢驗結果報告發出後,按感染性廢棄物要求進行無害化處理,檢出陽性的樣品應采用壓力蒸汽滅菌方式進行無害化處理。
5.2 肉毒毒素檢測
5.2.1 毒素液製備
取樣品勻液約40mL或均勻液體樣品25mL放入離心管,3000r/min離心10min~20min,收集上清液分為兩份放入無菌試管中,一份直接用於毒素檢測,一份用於胰酶處理後進行毒素檢測。液體樣品保留底部沉澱及液體約12mL,重懸,製備沉澱懸浮液備用。
胰酶處理:用1mol/L氫氧化鈉或1mol/L鹽酸調節上清液pH 至6.2,按9份上清液加1份10%胰酶(活力1∶250)水溶液,混勻,37℃孵育60min,期間間或輕輕搖動反應液。
5.2.2 檢出試驗
用5號針頭注射器分別取離心上清液和胰酶處理上清液腹腔注射小鼠3隻,每隻0.5mL,觀察和記錄小鼠48h內的中毒表現。典型肉毒毒素中毒症狀多在24h內出現,通常在6h內發病和死亡,其主要表現為豎毛、四肢癱軟,呼吸困難,呈現風箱式呼吸、腰腹部凹陷、宛如峰腰,多因呼吸衰竭而死亡,可初步判定為肉毒毒素所致。若小鼠在24h後發病或死亡,應仔細觀察小鼠症狀,必要時濃縮上清液重複試驗,以排除肉毒毒素中毒。若小鼠出現猝死(30min內)導致症狀不明顯時,應將毒素上清液進行適當稀釋,重複試驗。
注:毒素檢測動物試驗應遵循GB15193.2《食品安全國家標準 食品毒理學實驗室操作規範》的規定。
5.2.3 確證試驗
上清液或(和)胰酶處理上清液的毒素試驗陽性者,取相應試驗液3份,每份0.5mL,其中第一份加等量多型混合肉毒毒素診斷血清,混勻,37℃孵育30min;第二份加等量明膠磷酸鹽緩衝液,混勻後煮沸10min;第三份加等量明膠磷酸鹽緩衝液,混勻。將三份混合液分別腹腔注射小鼠各兩隻,每隻0.5mL,觀察96h內小鼠的中毒和死亡情況。
結果判定:若注射第一份和第二份混合液的小鼠未死亡,而第三份混合液小鼠發病死亡,並出現肉毒毒素中毒的特有症狀,則判定檢測樣品中檢出肉毒毒素。
5.2.4 毒力測定(選做項目)
取確證試驗陽性的試驗液,用明膠磷酸鹽緩衝液稀釋製備一定倍數稀釋液,如10倍、50倍、100倍、500倍等,分別腹腔注射小鼠各兩隻,每隻0.5mL,觀察和記錄小鼠發病與死亡情況至96h,計算最低致死劑量(MLD/mL或MLD/g),評估樣品中肉毒毒素毒力,MLD等於小鼠全部死亡的最高稀釋倍數乘以樣品試驗液稀釋倍數。例如,樣品稀釋兩倍製備的上清液,再稀釋100倍試驗液使小鼠全部死亡,而500倍稀釋液組存活,則該樣品毒力為200MLD/g。
5.2.5 定型試驗(選做項目)
根據毒力測定結果,用明膠磷酸鹽緩衝液將上清液稀釋至10MLD/mL~1000MLD/mL作為定型試驗液,分別與各單型肉毒毒素診斷血清等量混合(國產診斷血清一般為凍幹血清,用1mL生理鹽水溶解),37℃孵育30min,分別腹腔注射小鼠兩隻,每隻0.5mL,觀察和記錄小鼠發病與死亡情況至96h。同時,用明膠磷酸鹽緩衝液代替診斷血清,與試驗液等量混合作為小鼠試驗對照。
結果判定:某一單型診斷血清組動物未發病且正常存活,而對照組和其他單型診斷血清組動物發病死亡,則判定樣品中所含肉毒毒素為該型肉毒毒素。
注:未經胰酶激活處理的樣品上清液的毒素檢出試驗或確證試驗為陽性者,則毒力測定和定型試驗可省略胰酶激活處理試驗。
5.3 肉毒梭菌檢驗
5.3.1 增菌培養與檢出試驗
5.3.1.1 取出庖肉培養基4支和TPGY 肉湯管2支,隔水煮沸10min~15min,排除溶解氧,迅速冷卻,切勿搖動,在TPGY 肉湯管中緩慢加入胰酶液至液體石蠟液麵下肉湯中,每支1 mL,製備成TPGYT。
5.3.1.2 吸取樣品勻液或毒素製備過程中的離心沉澱懸浮液2mL接種至庖肉培養基中,每份樣品接種4支,2支直接放置35℃±1℃厭氧培養至5d,另2支放80℃保溫10min,再放置35℃±1℃厭氧培養至5d;同樣方法接種2支TPGYT肉湯管,28℃±1℃厭氧培養至5d。
注:接種時,用無菌吸管輕輕吸取樣品勻液或離心沉澱懸浮液,將吸管口小心插入肉湯管底部,緩緩放出樣液至肉湯中,切勿攪動或吹氣。
5.3.1.3 檢查記錄增菌培養物的濁度、產氣、肉渣顆粒消化情況,並注意氣味。肉毒梭菌培養物為產氣、肉湯渾濁(庖肉培養基中A 型和B型肉毒梭菌肉湯變黑)、消化或不消化肉粒、有異臭味。
5.3.1.4 取增菌培養物進行革蘭氏染色鏡檢,觀察菌體形態,注意是否有芽胞、芽胞的相對比例、芽胞在細胞內的位置。
5.3.1.5 若增菌培養物5d無菌生長,應延長培養至10d,觀察生長情況。
5.3.1.6 取增菌培養物陽性管的上清液,按5.2方法進行毒素檢出和確證試驗,必要時進行定型試驗,陽性結果可證明樣品中有肉毒梭菌存在。
注:TPGYT增菌液的毒素試驗無需添加胰酶處理。
5.3.2 分離與純化培養
5.3.2.1 增菌液前處理,吸取1mL增菌液至無菌螺旋帽試管中,加入等體積過濾除菌的無水乙醇,混勻,在室溫下放置1h。
5.3.2.2 取增菌培養物和經乙醇處理的增菌液分別劃線接種至卵黃瓊脂平板,35 ℃±1 ℃厭氧培養48h。
5.3.2.3 觀察平板培養物菌落形態,肉毒梭菌菌落隆起或扁平、光滑或粗糙,易成蔓延生長,邊緣不規則,在菌落周圍形成乳色沉澱暈圈(E型較寬,A 型和B型較窄),在斜視光下觀察,菌落表麵呈現珍珠樣虹彩,這種光澤區可隨蔓延生長擴散到不規則邊緣區外的暈圈。
5.3.2.4 菌株純化培養,在分離培養平板上選擇5個肉毒梭菌可疑菌落,分別接種卵黃瓊脂平板,35℃±1℃,厭氧培養48h,按5.3.2.3觀察菌落形態及其純度。
5.3.3 鑒定試驗
5.3.3.1 染色鏡檢
挑取可疑菌落進行塗片、革蘭氏染色和鏡檢,肉毒梭菌菌體形態為革蘭氏陽性粗大杆菌、芽胞卵圓形、大於菌體、位於次端,菌體呈網球拍狀。
5.3.3.2 毒素基因檢測
a) 菌株活化:挑取可疑菌落或待鑒定菌株接種TPGY,35℃±1℃厭氧培養24h。
b) DNA 模板製備:吸取TPGY培養液1.4mL至無菌離心管中,14000×g 離心2min,棄上清,加入1.0mLPBS懸浮菌體,14000×g 離心2min,棄上清,用400μLPBS重懸沉澱,加入10mg/mL 溶菌酶溶液100μL,搖勻,37 ℃水浴15 min,加入10 mg/mL 蛋白酶K 溶液
10μL,搖勻,60℃水浴1h,再沸水浴10min,14000×g 離心2min,上清液轉移至無菌小離心管中,加入3mol/LNaAc溶液50μL和95%乙醇1.0mL,搖勻,-70 ℃或-20 ℃放置30min,14000×g 離心10min,棄去上清液,沉澱幹燥後溶於200μLTE緩衝液,置於-20℃保
存備用。
注:根據實驗室實際情況,也可采用常規水煮沸法或商品化試劑盒製備DNA模板。
c) 核酸濃度測定(必要時):取5μLDNA 模板溶液,加超純水稀釋至1mL,用核酸蛋白分析儀或紫外分光光度計分別檢測260nm 和280nm 波段的吸光值A260和A280。按式(1)計算DNA濃度。當濃度在0.34μg/mL~340μg/mL或A260/A280比值在1.7~1.9之間時,適宜於PCR擴增。
C =A260 ×N ×50 …………………………(1)
式中:
C ———DNA 濃度,單位為微克每毫升(μg/mL);
A260———260nm 處的吸光值;
N ———核酸稀釋倍數。
d) PCR擴增:
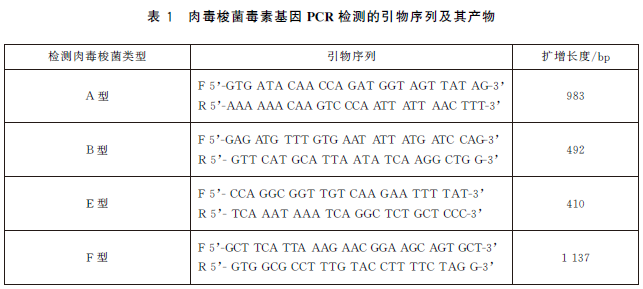
1) 分別采用針對各型肉毒梭菌毒素基因設計的特異性引物(見表1)進行PCR擴增,包括A型肉毒毒(botulinumneurotoxinA,bont/A)、B型肉毒毒素(botulinumneurotoxinB,bont/B)、E型肉毒毒素(botulinumneurotoxinE,bont/E)和F型肉毒毒素(botulinumneurotoxinF,bont/F),每個PCR反應管檢測一種型別的肉毒梭菌。
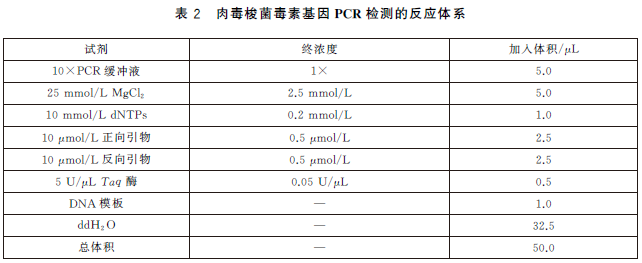
2) 反應體係配製見表2,反應體係中各試劑的量可根據具體情況或不同的反應總體積進行相應調整。
3) 反應程序,預變性95℃、5min;循環參數94℃、1min,60℃、1min,72℃、1min;循環數40;後延伸72℃,10min;4℃保存備用。
4) PCR擴增體係應設置陽性對照、陰性對照和空白對照。用含有已知肉毒梭菌菌株或含肉毒毒素基因的質控品作陽性對照、非肉毒梭菌基因組DNA 作陰性對照、無菌水作空白對照。
e) 凝膠電泳檢測PCR擴增產物,用0.5×TBE緩衝液配製1.2%~1.5%的瓊脂糖凝膠,凝膠加熱融化後冷卻至60℃左右加入溴化乙錠至0.5μg/mL或Goldview5μL/100mL製備膠塊,取10μLPCR擴增產物與2.0μL6×加樣緩衝液混合,點樣,其中一孔加入DNA 分子量標準。0.5×TBE電泳緩衝液,10V/cm 恒壓電泳,根據溴酚藍的移動位置確定電泳時間,用紫外檢測儀或凝膠成像係統觀察和記錄結果。PCR擴增產物也可采用毛細管電泳儀進行檢測。
f) 結果判定,陰性對照和空白對照均未出現條帶,陽性對照出現預期大小的擴增條帶(見表1),判定本次PCR檢測成立;待測樣品出現預期大小的擴增條帶,判定為PCR結果陽性,根據表1判定肉毒梭菌菌株型別,待測樣品未出現預期大小的擴增條帶,判定PCR結果為陰性。注:PCR試驗環境條件和過程控製應參照GB/T27403《實驗室質量控製規範 食品分子生物學檢測》規定執行。
5.3.3.3 菌株產毒試驗
將PCR陽性菌株或可疑肉毒梭菌菌株接種庖肉培養基或TPGYT 肉湯(用於E型肉毒梭菌),按5.3.1.2條件厭氧培養5d,按5.2方法進行毒素檢測和(或)定型試驗,毒素確證試驗陽性者,判定為肉毒梭菌,根據定型試驗結果判定肉毒梭菌型別。
注:根據PCR陽性菌株型別,可直接用相應型別的肉毒毒素診斷血清進行確證試驗。
6 結果報告
6.1 肉毒毒素檢測結果報告
根據5.2.2和5.2.3試驗結果,報告25g(mL)樣品中檢出或未檢出肉毒毒素。
根據5.2.5定型試驗結果,報告25g(mL)樣品中檢出某型肉毒毒素。
6.2 肉毒梭菌檢驗結果報告
根據5.3各項試驗結果,報告樣品中檢出或未檢出肉毒梭菌或檢出某型肉毒梭菌。
附 錄 A
培養基和試劑
A.1 庖肉培養基
A.1.1 成分
新鮮牛肉 500.0g
蛋白腖30.0g
酵母浸膏5.0g
磷酸二氫鈉5.0g
葡萄糖3.0g
可溶性澱粉2.0g
蒸餾水1000.0mL
A.1.2 製法
稱取新鮮除去脂肪與筋膜的牛肉500.0g,切碎,加入蒸餾水1000mL和1mol/L氫氧化鈉溶液25mL,攪拌煮沸15min,充分冷卻,除去表層脂肪,紗布過濾並擠出肉渣餘液,分別收集肉湯和碎肉渣。在肉湯中加入成分表中其他物質並用蒸餾水補足至1000mL,調節pH 至7.4±0.1,肉渣涼至半幹。在20mm×150mm 試管中先加入碎肉渣1cm~2cm 高,每管加入還原鐵粉0.1g~0.2g或少許鐵屑,再加入配製肉湯15mL,最後加入液體石蠟覆蓋培養基0.3cm~0.4cm,121 ℃高壓蒸汽滅菌20min。
A.2 胰蛋白酶胰蛋白腖葡萄糖酵母膏肉湯(TPGYT)
A.2.1 基礎成分(TPGY 肉湯)
胰酪腖(trypticase) 50.0g
蛋白腖5.0g
酵母浸膏20.0g
葡萄糖4.0g
硫乙醇酸鈉1.0g
蒸餾水1000.0mL
A.2.2 胰酶液
稱取胰酶(1∶250)1.5g,加入100mL蒸餾水中溶解,膜過濾除菌,4℃保存備用。
A.2.3 製法
將A.2.1中成分溶於蒸餾水中,調節pH 至7.2±0.1,分裝20mm×150mm 試管,每管15mL,加入液體石蠟覆蓋培養基0.3cm~0.4cm,121℃高壓蒸汽滅菌10min。冰箱冷藏,兩周內使用。臨用接種樣品時,每管加入胰酶液1.0mL。
A.3 卵黃瓊脂培養基
A.3.1 基礎培養基成分
酵母浸膏5.0g
胰腖5.0g
腖(proteosepeptone) 20.0g
氯化鈉5.0g
瓊脂20.0g
蒸餾水1000.0mL
A.3.2 卵黃乳液
用硬刷清洗雞蛋2個~3個,瀝幹,殺菌消毒表麵,無菌打開,取出內容物,棄去蛋白,用無菌注射器吸取蛋黃,放入無菌容器中,加等量無菌生理鹽水,充分混合調均,4℃保存備用。
A.3.3 製法
將A.3.1中成分溶於蒸餾水中,調節pH 至7.0±0.2,分裝錐形瓶,121 ℃高壓蒸汽滅菌15min,冷卻至50℃左右,按每100mL基礎培養基加入15mL卵黃乳液,充分混勻,傾注平板,35℃培養24h進行無菌檢查後,冷藏備用。
A.4 明膠磷酸鹽緩衝液
A.4.1 成分
明膠2.0g
磷酸氫二鈉(Na2HPO4) 4.0g
蒸餾水1000.0mL
A.4.2 製法
將A.4.1中成分溶於蒸餾水中,調節pH 至6.2,121℃高壓蒸汽滅菌15min。
A.5 革蘭氏染色
A.5.1 結晶紫染色液
A.5.1.1 成分
結晶紫1.0g
95%乙醇20.0mL
1%草酸銨水溶液80.0mL
A.5.1.2 製法
將結晶紫完全溶於乙醇中,再與草酸銨溶液混合。
A.5.2 革蘭氏碘液
A.5.2.1 成分
碘1.0g
碘化鉀2.0g
蒸餾水300.0mL
A.5.2.2 製法
將碘和碘化鉀混合,加入少許蒸餾水充分振搖,待完全溶解後,再加蒸餾水至300mL。
A.5.3 沙黃複染液
A.5.3.1 成分
沙黃0.25g
95%乙醇10.0mL
蒸餾水90.0mL
A.5.3.2 製法
將沙黃溶於乙醇中,再加蒸餾水至100mL。
A.5.4 染色方法
塗片在酒精燈火焰上固定,滴加結晶紫染色液覆蓋,染色1min,水洗;滴加革蘭氏碘液覆蓋,作用1min,水洗;滴加95%乙醇脫色約15s~30s(可將乙醇覆蓋整個塗片,立即傾去,再用乙醇覆蓋塗片,作用約10s,傾去脫色液,滴加乙醇從塗片流下至出現無色為止),水洗;滴加沙黃複染液覆蓋,染色1min,水洗,待幹、鏡檢。
A.6 胰蛋白酶溶液
A.6.1 成分
胰蛋白酶(1∶250) 10.0g
蒸餾水100.0mL
A.6.2 製法
將胰蛋白酶溶於蒸餾水中,膜過濾除菌,4℃保存備用。
A.7 磷酸鹽緩衝液(PBS)
A.7.1 成分
氯化鈉7.650g
磷酸氫二鈉0.724g
磷酸二氫鉀0.210g
超純水1000.0mL
A.7.2 製法
準確稱取A.7.1中化學試劑,溶於超純水中,測試pH7.4。

