











對於微生物實驗室的小夥伴們來說,每天除了麵對接樣,檢測樣品,配培養基等各種瓶瓶罐罐交響曲以外,製備合適濃度的菌懸液應該是每天的頭號大事了,畢竟有太多的項目需要合適濃度的菌懸液,產品方法適用性,培養基促生長測試,最要命的是每天產品檢測中的陽性對照菌菌懸液的製備。
小編今天就給大家分享一篇文章。
1.操作流程:這裏以大家最常用的大腸埃希菌為例,其它菌種方法類似。
①菌種製備:從菌種保藏管中吸取少量菌液,轉接到新鮮的TSB中,於30℃-35℃培養箱中培養18-24小時。
②稀釋:
取步驟1的培養物1ml,加入到9ml的pH7.0 氯化鈉蛋白質緩衝液中,進行倍比稀釋。
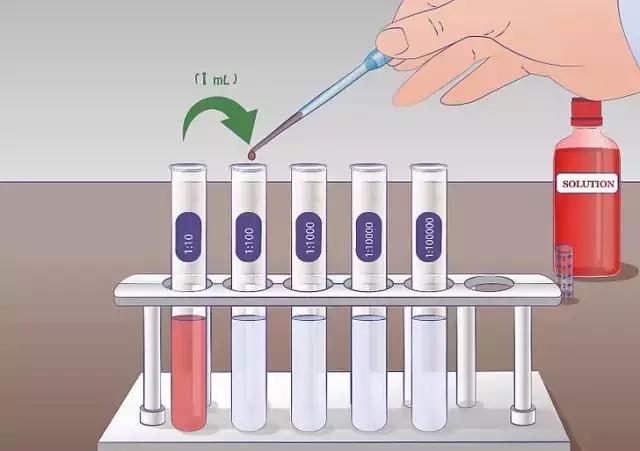
③平板計數:
取稀釋好的菌液,一般取3個稀釋級,每個梯度取2ml,分別加入兩塊90cm的平皿中,每皿加入1ml菌液,傾注45℃左右的已經經過確定的TSA培養基,輕輕搖勻,靜置,培養基凝固後,置30-35℃培養箱中倒置培養48小時。
④菌落計數:
將培養後的平板,置於菌落計數器下進行菌落計數,以確定哪個稀釋級的濃度能夠滿足測試的要求。
2.注意事項:
菌種製備:
也可以使用TSA平板進行培養,如果轉接的是冷凍保藏管中的菌,最好再轉接一次,使用第二次轉接的菌種。
稀釋:
取菌液的時候,需要先對菌液進行振蕩或吹打混勻,方可吸取菌液。可以不用進行倍比稀釋,隻要能保證最後加入到測試樣品中的菌的數量符合要求即可。
平板計數:
取菌液時同樣需要先將試管中的菌液進行混勻。
培養基菌落計數:
不建議逐日觀察結果,因為平板中可能有凝集水, 逐日觀察拿動平板,可能會導致水落到菌落上,菌跟著水流到下一個空白地方,導致結果不準確;另外如果是黴菌,因為有孢子,拿動也會導致孢子落到平板空白地方,影響結果。
3.事後思考:
①菌液的使用:
菌懸液使用有時效性要求
2015版<中國藥典>和<歐洲藥典>8.0版要求如果放置在室溫,菌懸液必須在2小時內使用,如果放置在2-8℃保存,可以在24小時內使用。
那麽問題來了,菌懸液的菌的數量需要在48小時後才能確定,但是在24小時之內菌懸液必須使用,所以在不知道菌含量的情況下,樣品測試需要做至少三個梯度。
筆者之前在微生物實驗室做了5次的菌懸液製備,為了保證實驗的成功,每次都是要做三個梯度,雖然大多數都是同一個稀釋級的含量符合要求,但是還是偶爾有另一個稀釋級才符合要求的時候,所以筆者每次都乖乖的做三個梯度的測試,還好筆者那個時候依據的法規中,日常的無菌檢查和控製菌檢查中沒有陽性對照的要求。
這裏說的三個梯度不是說隻是計數,而是菌懸液實際運用的測試中也需要三個梯度,舉個例子,某個無菌產品無菌檢查中的陽性對照測試,需要做三個對照。當然,同樣的產品方法適用性,培養基促生長測試也是如此。流程圖如下:
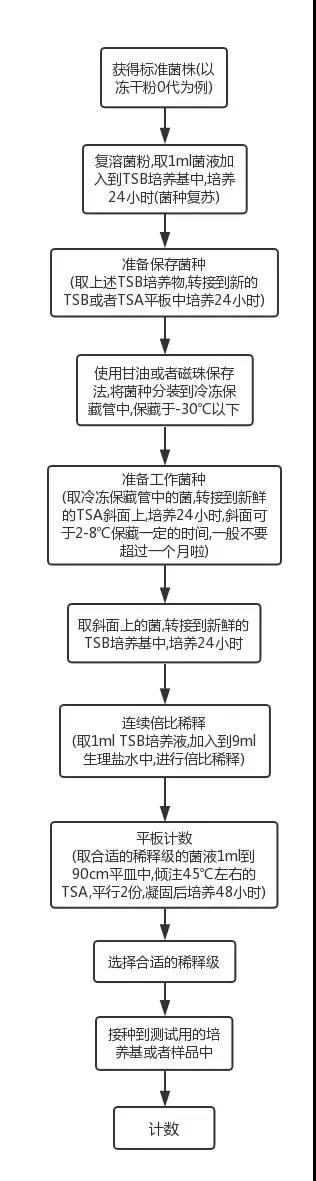
②步驟的繁瑣:
這個流程圖中,還是省略了一些步驟,一句話帶過的倍比稀釋,做過的小夥伴們知道,這個說起來容易做起來難。
另外在接收菌種和從冷凍保藏管中取出菌種來使用時,還需要進行相應的鑒定,所以不要覺得這個流程好冗長,其實已經是簡單版的。
上一篇:劃重點啦!《食品安全國家標準食品微生物學檢驗 沙門氏菌檢驗》(GB4789.4-2016)
下一篇:生活飲用水中微生物的檢測方法

