











控製菌檢查法係用於在規定的試驗條件下,檢查供試品中是否存在特定的微生物。
當本法用於檢查非無菌製劑及其原、輔料是否符合相應的微生物限度標準時,應按下列規定進行檢驗,包括樣品取樣量和結果判斷等。
本檢查法可采用替代的微生物檢查法,包括自動檢測方法,但必須證明替代方法等效於藥典規定的檢查方法。
供試液製備及實驗環境要求同“非無菌產品微生物限度檢查:微生物計數法”(通則1105)。
如果供試品具有抗菌活性,應盡可能去除或中和。供試品檢查時, 若使用了中和劑或滅活劑,應確認有效性及對微生物無毒性。
供試液製備時如果使用了表麵活性劑,應確認其對微生物無毒性以及與所使用中和劑或滅活劑的相容性。
培養基適用性檢查和控製菌檢查方法適用性試驗
供試品控製菌檢查中所使用的培養基應進行適用性檢查。
供試品的控製菌檢查方法應進行方法適用性試驗,以確認所采用的方法適合於該產品的控製菌檢查。
若檢驗程序或產品發生變化可能影響檢驗結果時,控製菌檢查方法應重新進行適用性試驗。
菌種及菌液製備
菌種 試驗用菌株的傳代次數不得超過5 代(從菌種保藏中心獲得的幹燥菌種為第0 代),並采用適宜的菌種保藏技術進行保存,以保證試驗菌株的生物學特性。
金黃色葡萄球菌(Staphylococcus aureus)〔CMCC(B)26 003〕
銅綠假單胞菌(Pseudomonas aeruginosa)〔CMCC(B)10 104〕
大腸埃希菌(Escherichia coli)〔CMCC(B)44 102〕
乙型副傷寒沙門菌(Salmonella paratyphi B)〔CMCC(B)50 094〕
白色念珠菌(Candida albicans)〔CMCC(F)98 001〕
生孢梭菌(Clostridium sporogenes)〔CMCC(B)64 941〕
菌液製備 將金黃色葡萄球菌、銅綠假單胞菌、大腸埃希菌、沙門菌分別接種於胰酪大豆腖液體培養基中或在胰酪大豆腖瓊脂培養基上,30~35℃培養18~24 小時;將白色念珠菌接種於沙氏葡萄糖瓊脂培養基上或沙氏葡萄糖液體培養基中,20~25℃培養2~3 天;將生孢梭菌接種於梭菌增菌培養基中置厭氧條件下30~35℃培養24~48 小時或接種於硫乙醇酸鹽流體培養基中30~35℃培養18~24 小時。上述培養物用pH7.0 無菌氯化鈉-蛋白腖緩衝液或0.9%無菌氯化鈉溶液製成適宜濃度的菌懸液。
菌液製備後若在室溫下放置,應在2 小時內使用;若保存在2~8℃,可在24 小時內使用。生孢梭菌孢子懸液可替代新鮮的菌懸液,穩定的孢子懸液可保存在2~8℃,在驗證過的貯存期內使用。
陰性對照
為確認試驗條件是否符合要求,應進行陰性對照試驗, 陰性對照試驗應無菌生長。如陰性對照有菌生長,應進行偏差調查。
培養基適用性檢查
控製菌檢查用的成品培養基、由脫水培養基或按處方配製的培養基均應進行培養基的適用性檢查。
控製菌檢查用培養基的適用性檢查項目包括促生長能力、抑製能力及指示特性的檢查。各培養基的檢測項目及所用的菌株見表1。
表1 控製菌檢查用培養基的促生長能力、抑製能力和指示特性
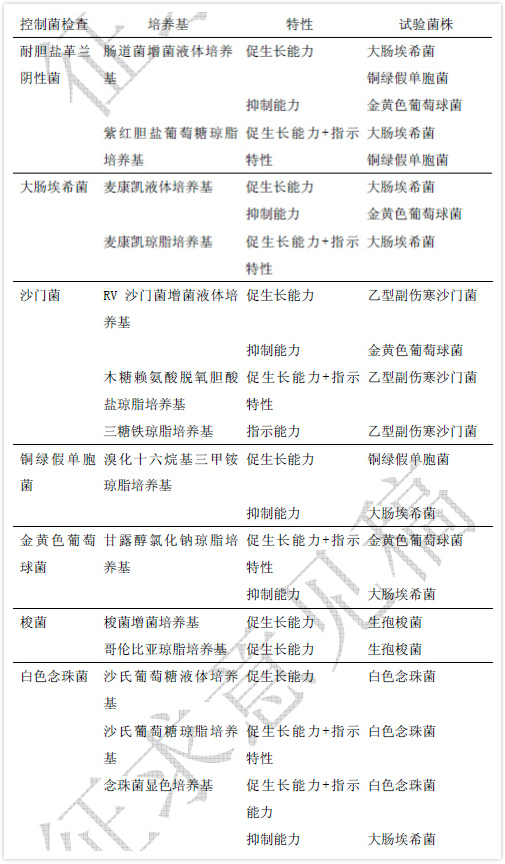
液體培養基促生長能力檢查 分別接種不大於100cfu 的試驗菌(見表1)於被檢培養基和對照培養基中,在相應控製菌檢查規定的培養溫度及不長於規定的最短培養時間下培養,與對照培養基管比較,被檢培養基管試驗菌應生長良好。
固體培養基促生長能力檢查 用塗布法分別接種不大於100cfu 的試驗菌(見表1)於被檢培養基和對照培養基平板上,在相應控製菌檢查規定的培養溫度及不長於規定的最短培養時間下培養,被檢培養基與對照培養基上生長的菌落大小、形態特征應一致。
培養基抑製能力檢查 接種不少於100cfu 的試驗菌(見表1)於被檢培養基和對照培養基中,在相應控製菌檢查規定的培養溫度及不短於規定的最長培養時間下培養,試驗菌應不得生長。
培養基指示特性檢查 用塗布法分別接種不大於100cfu 的試驗菌(見表1)於被檢培養基和對照培養基平板上,在相應控製菌檢查規定的培養溫度及不長於規定的最短培養時間下培養,被檢培養基上試驗菌生長的菌落大小、形態特征、指示劑反應情況等應與對照培養基一致。
控製菌檢查方法適用性試驗
供試液製備 按下列“供試品檢查”中的規定製備供試液。
試驗菌 根據各品種項下微生物限度標準中規定檢查的控製菌選擇相應試驗菌株,確認耐膽鹽革蘭陰性菌檢查方法時,采用大腸埃希菌和銅綠假單胞菌為試驗菌。
適用性試驗 按控製菌檢查法取規定量供試液及不大於100cfu 的試驗菌接入規定的培養基中;采用薄膜過濾法時,取規定量供試液,過濾,衝洗,試驗菌應加在最後一次衝洗液中,過濾後,注入規定的培養基或取出濾膜接入規定的培養基中。依相應的控製菌檢查方法,在規定的溫度及最短時間下培養,應能檢出所加試驗菌相應的反應特征。
結果判斷 上述試驗若檢出試驗菌,按此供試液製備法和控製菌檢查方法進行供試品檢查;若未檢出試驗菌,應消除供試品的抑菌活性(見非無菌產品微生物檢查:微生物計數法(附錄×××)中的“抗菌活性的去除或滅活”),並重新進行方法適用性試驗。
如果經過試驗確證供試品對試驗菌的抗菌作用無法消除,可認為受抑製的微生物不可能存在於該供試品中,選擇抑菌成份消除相對徹底的方法進行供試品的檢查。
供試品檢查
供試品的控製菌檢查應按經方法適用性試驗確認的方法進行。
陽性對照試驗 陽性對照試驗方法同供試品的控製菌檢查,對照菌的加量應不大於100cfu。陽性對照試驗應檢出相應的控製菌。
陰性對照試驗 以稀釋劑代替供試液照相應控製菌檢查法檢查,陰性對照試驗應無菌生長。如果陰性對照有菌生長,應進行偏差調查。
耐膽鹽革蘭陰性菌(Bile-Tolerant Gram-Negative Bacteria)
供試液製備和預培養 取供試品,用胰酪大豆腖液體作為稀釋劑照“非無菌產品微生物限度檢查:微生物計數法” (通則1105)製成1:10 供試液,混勻,在20~25℃培養,培養時間應使供試品中的細菌充分恢複但不增殖(約2 小時)。
未檢出試驗
除另有規定外,取相當於1g 或1mL 供試品的上述預培養物接種至腸道菌增菌液體培養基中,30~35℃培養24~48 小時後,劃線接種於紫紅膽鹽葡萄糖瓊脂培養基平板上,30~35℃培養18~24 小時。如果平板上無菌落生長,判供試品未檢出耐膽鹽革蘭陰性菌。
定量試驗
選擇和分離培養 取相當於0.1g、0.01g 和0.001g(或0.1mL、0.01mL 和0.001mL)供試品的預培養物或其稀釋液分別接種至腸道菌增菌液體培養基中,30~35℃培養24~48 小時。上述每一培養物分別劃線接種於紫紅膽鹽葡萄糖瓊脂培養基平板上,30~35℃培養18~24 小時。
結果判斷 若紫紅膽鹽葡萄糖瓊脂培養基平板上有菌落生長,則對應培養管為陽性,否則為陰性。根據各培養管檢查結果,從表2 查對1g 或1ml 供試品中含有耐膽鹽革蘭陰性菌的最大可能數。
表2 耐膽鹽革蘭陰性菌的可能菌數

注:⑴ +代表紫紅膽鹽葡萄糖瓊脂平板上有菌落生長;-代表紫紅膽鹽葡萄糖瓊脂平板上無菌落生長。
⑵ 若供試品量減少10 倍(如0.01g 或0.01ml,0.001g 或0.001ml,0.0001g 或0.0001ml),則每1g(或1mL)供試品中可能的菌數(N)應相應增加10 倍。
大腸埃希菌(Escherichia coli)
供試液製備和增菌培養 取供試品,照“非無菌產品微生物限度檢查:微生物計數法” (通則1105)製成1:10 供試液。取相當於1g 或1mL 供試品的供試液,接種至適宜體積(經方法適用性試驗確定的)的胰酪大豆腖液體培養基中,混勻,30~35℃培養18~24 小時。
選擇和分離培養 取上述預培養物1mL 接種至100mL 麥康凱液體培養基中,42~44℃培養24~48 小時。取麥康凱液體培養物劃線接種於麥康凱瓊脂培養基平板上,30~35℃培養18~72 小時。
結果判斷 若麥康凱瓊脂培養基平板上有菌落生長,應進行分離、純化及適宜的鑒定試驗, 確證是否為大腸埃希菌;若麥康凱瓊脂培養基平板上沒有菌落生長,或雖有菌落生長但鑒定結果為陰性,判供試品未檢出大腸埃希菌。
沙門菌(Salmonella)
供試液製備和增菌培養 取10g 或10mL 供試品直接或處理後接種至適宜體積(經方法適用性試驗確定的)的胰酪大豆腖液體培養基中,混勻,30~35℃培養18~24 小時。
選擇和分離培養 取上述預培養物0.1mL 接種至10mL RV 沙門增菌液體培養基中,30~35℃培養18~24 小時。取少量RV 沙門菌增菌液體培養物劃線接種於木糖賴氨酸脫氧膽酸鹽瓊脂培養基平板上,30~35℃培養18~48 小時。
沙門菌在木糖賴氨酸脫氧膽酸鹽瓊脂培養基平板上生長良好,菌落為淡紅色或無色、透明或半透明、中心有或無黑色。用接種針挑選疑似菌落於三糖鐵瓊脂培養基高層斜麵上進行斜麵和高層穿刺接種,培養18~24 小時,或采用其它適宜方法進一步鑒定。
結果判斷 若木糖賴氨酸脫氧膽酸鹽瓊脂培養基平板上有疑似菌落生長,且三糖鐵瓊脂培養基的斜麵為紅色、底層為黃色,或斜麵黃色、底層黃色或黑色,應進一步進行適宜的鑒定試驗, 確證是否為沙門菌。如果平板上沒有菌落生長,或雖有菌落生長但鑒定結果為陰性,或三糖鐵瓊脂培養基的斜麵未見紅色、底層未見黃色;或斜麵黃色、底層未見黃色黑色,判供試品未檢出沙門菌。
銅綠假單胞菌(Pseudomonas aeruginosa)
供試液製備和增菌培養 取供試品,照“非無菌產品微生物限度檢查:微生物計數法” (通則1105)製成1:10 供試液。取相當於1g 或1mL 供試品的供試液,接種至適宜體積(經方法適用性試驗確定的)的胰酪大豆腖液體培養基中,混勻。30~35℃培養18~24 小時。
選擇和分離培養 取上述預培養物劃線接種於溴化十六烷基三甲銨瓊脂培養基平板上,30~35℃培養18~72 小時。
取上述平板上生長的菌落進行氧化酶試驗,或采用其它適宜方法進一步鑒定。
氧化酶試驗 將潔淨濾紙片置於平皿內,用無菌玻棒取上述平板上生長的菌落塗於濾紙片上,滴加新配製的1%二鹽酸二甲基對苯二胺試液,在30 秒內若培養物呈粉紅色並逐漸變為紫紅色為氧化酶試驗陽性,否則為陰性。
結果判斷 若溴化十六烷基三甲銨瓊脂培養基平板上有菌落生長,且氧化酶試驗陽性,應進一步進行適宜的鑒定試驗, 確證是否為銅綠假單胞菌。如果平板上沒有菌落生長,或雖有菌落生長但鑒定結果為陰性,或氧化酶試驗陰性,判供試品未檢出銅綠假單胞菌。
金黃色葡萄球菌(Staphylococcus aureus)
供試液製備和增菌培養 取供試品,照“非無菌產品微生物限度檢查:微生物計數法” (通則1105)製成1:10 供試液。取相當於1g 或1mL 供試品的供試液,接種至適宜體積(經方法適用性試驗確定的)的胰酪大豆腖液體培養基中,混勻。30~35℃培養18~24 小時。
選擇和分離培養 取上述預培養物劃線接種於甘露醇氯化鈉瓊脂培養基平板上,30~35℃培養18~72 小時。
結果判斷 若甘露醇氯化鈉瓊脂培養基平板上有黃色菌落或外周有黃色環的白色菌落生長,應進行分離、純化及適宜的鑒定試驗, 確證是否為金黃色葡萄球菌;若平板上沒有與上述形態特征相符或疑似的菌落生長,或雖有相符或疑似的菌落生長但鑒定結果為陰性,判供試品未檢出金黃色葡萄球菌。
梭菌(Clostridia)
供試液製備和熱處理 取供試品,照“非無菌產品微生物限度檢查:微生物計數法” (通則1105)製成1:10 供試液。取相當於1g 或1mL 供試品的供試液2 份,其中1 份置80℃保溫10 分鍾後迅速冷卻。
選擇和分離培養 將上述2 份供試液分別接種至適宜體積(經方法適用性試驗確定的)的梭菌增菌培養基中,置厭氧條件下30~35℃培養48 小時。取上述每一培養物少量,分別塗抹接種於哥倫比亞瓊脂培養基平板上,置厭氧條件下30~35℃培養48~72 小時。
過氧化氫酶試驗 取上述平板上生長的菌落,置潔淨玻片上,滴加3%過氧化氫試液,若菌落表麵有氣泡產生,為過氧化氫酶試驗陽性,否則為陰性。
結果判斷 若哥倫比亞瓊脂培養基平板上有帶或不帶芽孢的厭氧杆菌生長,且過氧化氫酶反應陰性的,應進一步進行適宜的鑒定試驗, 確證是否為梭菌;如果哥倫比亞瓊脂培養基平板上沒有厭氧杆菌生長,或雖有相符或疑似的菌落生長但鑒定結果為陰性,或過氧化氫酶反應陽性,判供試品未檢出梭菌。
白色念珠菌(Candida albicans)
供試液製備和增菌培養 取供試品,照“非無菌產品微生物限度檢查:微生物計數法” (通則1105)製成1:10 供試液。取相當於1g 或1mL 供試品的供試液,接種到100mL 沙氏葡萄糖液體培養基中,混勻,30~35℃培養3~5 天。
選擇和分離 取上述預培養物劃線接種於沙氏葡萄糖瓊脂培養基平板上,30~35℃培養24~48 小時。
白色念珠菌在沙氏葡萄糖瓊脂培養基上生長的菌落呈乳白色,偶見淡黃色,表麵光滑有濃酵母氣味,培養時間稍久則菌落增大,顏色變深、質地變硬或有皺褶。挑取疑似菌落接種至念珠菌顯色培養基平板上,培養24~48 小時(必要時延長至72 小時),或采用其它適宜方法進一步鑒定。
結果判斷 若沙氏葡萄糖瓊脂培養基平板上有疑似菌落生長,且疑似菌在念珠菌顯色培養基平板上生長的菌落陽性反應,應進一步進行適宜的鑒定試驗, 確證是否為白色念珠菌;若沙氏葡萄糖瓊脂培養基平板上沒有菌落生長,或雖有菌落生長但鑒定結果為陰性,或疑似菌在念珠菌顯色培養基平板上生長的菌落呈陰性反應,判供試品未檢出白色念珠菌。
稀釋液
稀釋液配製後,應采用驗證合格的滅菌程序滅菌。
1. pH7.0 無菌氯化鈉-蛋白腖緩衝液 照無菌檢查法(通則1101)製備。
2. pH6.8 無菌磷酸鹽緩衝液、pH7.2 無菌磷酸鹽緩衝液 、pH7.6 無菌磷酸鹽緩衝液按緩衝液 照緩衝液(通則8004)配製後,過濾,分裝,滅菌。
如需要,可在上述稀釋液滅菌前或滅菌後加入表麵活性劑或中和劑等。
3. 0.9%無菌氯化鈉溶液 取氯化鈉9.0g,加水溶解使成1000ml,過濾,分裝,滅菌。
培養基及其製備方法
培養基可按以下處方製備,也可使用按該處方生產的符合要求的脫水培養基。配製後,應按驗證過的高壓滅菌程序滅菌。
1.胰酪大豆腖液體培養基(TSB)、胰酪大豆腖瓊脂培養基(TSA)、沙氏葡萄糖液體培養基(SDB) 照無菌檢查法(通則1101)製備。
照無菌檢查法(通則1101)製備。如使用含抗生素的沙氏葡萄糖瓊脂培養基,應確認培養基中所加的抗生素量不影響檢品中黴菌和酵母菌的生長。
馬鈴薯(去皮) 200g 瓊脂 14.0g
葡萄糖 20.0g 純化水 1000mL
取馬鈴薯,切成小塊,加水1000mL,煮沸20-30min,用6-8 層紗布過濾,取濾液補水至1000ml,調節pH 值使滅菌後在25℃的pH 值為5.6±0.2,加入瓊脂,加熱溶化後, 再加入葡萄糖,搖勻,分裝,滅菌。
腖 5.0g 玫瑰紅鈉 0.0133g
葡萄糖 10.0g 瓊脂 14.0g
磷酸二氫鉀 1.0g 純化水 1000ml
硫酸鎂 0.5g
除葡萄糖、玫瑰紅鈉外,取上述成分,混合,微溫溶解,加入葡萄糖、玫瑰紅鈉,搖勻,分裝,滅菌。
5、硫乙醇酸鹽流體培養基 照無菌檢查法(通則1101)製備
明膠胰酶水解物 10.0g 二水合磷酸氫二鈉 8.0g
牛膽鹽 20.0g 亮綠 15mg
葡萄糖 5.0g 純化水 1000mL
磷酸二氫鉀 2.0g
除葡萄糖、亮綠外,取上述成分,混合,微溫溶解,調節pH 值使加熱後在25℃的pH 值為7.2±0.2,加入葡萄糖、亮綠,加熱至100℃ 30 分鍾,立即冷卻。
酵母浸出粉 3.0g 中性紅 30mg
明膠胰酶水解物 7.0g 結晶紫 2mg
脫氧膽酸鈉 1.5g 瓊脂 15.0g
葡萄糖 10.0g 純化水 1000mL
氯化鈉 5.0g
除葡萄糖、中性紅、結晶紫、瓊脂外,取上述成分,混合,微溫溶解,調節pH使加熱後在25℃的pH 值為7.4±0.2。加入葡萄糖、中性紅、結晶紫、瓊脂,加熱煮沸(不能在高壓滅菌器中加熱)。
8、麥康凱液體培養基
明膠胰酶水解物 20.0g 溴甲酚紫 10mg
乳糖 10.0g 純化水 1000mL
牛膽鹽 5.0g
除乳糖、溴甲酚紫外,取上述成分,混合,微溫溶解,調節pH 值使滅菌後在25℃的pH 值為7.3±0.2,加入乳糖、溴甲酚紫,分裝,滅菌。
9、麥康凱瓊脂培養基
明膠胰酶水解物 17.0g 中性紅 30.0mg
腖(肉或酪蛋白) 3.0g 結晶紫 1mg
乳糖 10.0g 瓊脂 13.5g
脫氧膽酸鈉 1.5g 純化水 1000mL
氯化鈉 5.0g
除乳糖、中性紅、結晶紫、瓊脂外,取上述成分,混合,微溫溶解,調節pH值使滅菌後在25℃的pH 值為7.1±0.2,加入乳糖、中性紅、結晶紫、瓊脂,加熱煮沸1 分鍾,並不斷振搖,分裝,滅菌。
大豆腖 4.5g 六水合氯化鎂 29.0g
氯化鈉 8.0g 孔雀綠 36mg
磷酸氫二鉀 0.4g 純化水 1000mL
磷酸二氫鉀 0.6g
除孔雀綠外,取上述成分,混合,微溫溶解,調節pH 值使滅菌後在25℃的pH 值為5.2±0.2。加入孔雀綠,分裝,滅菌,滅菌溫度不能超過115℃。
酵母浸出粉 3.0g 氯化鈉 5.0g
L-賴氨酸 5.0g 硫代硫酸鈉 6.8g
木糖 3.5g 枸櫞酸鐵銨 0.8g
乳糖 7.5g 酚紅 80mg
蔗糖 7.5g 瓊脂 13.5g
脫氧膽酸鈉 2.5g 純化水 1000mL
除三種糖、酚紅、瓊脂外,取上述成分,混合,微溫溶解,調節pH 值使加熱後在25℃的pH 值為7.4±0.2,加入三種糖、酚紅、瓊脂,加熱至沸騰,冷至50℃傾注平皿(不能在高壓滅菌器中加熱)。
腖 20.0g 硫酸亞鐵 0.2g
牛肉浸出粉 5.0g 硫代硫酸鈉 0.2g
乳糖 10.0g 0.2%酚磺酞指示液 12.5ml
蔗糖 10.0g 瓊脂 12.0g
葡萄糖 1.0g 純化水 1000ml
氯化鈉 5.0g
除三種糖、0.2%酚磺酞指示液、瓊脂外,取上述成分,混合,微溫溶解, 調節pH 值使滅菌後在25℃的pH 值為7.3±0.1,加入瓊脂,加熱溶化後,再加入其餘各成分,搖勻,分裝,滅菌,製成高底層(2~3cm)短斜麵。
明膠胰酶水解物 20.0g 甘油 10mL
氯化鎂 1.4g 瓊脂 13.6g
硫酸鉀 10.0g 溴化十六烷基三甲銨 0.3g
純化水 1000mL
除瓊脂外,取上述成分,混合,微溫溶解,調節pH 使滅菌後在25℃的pH 值為7.4±0.2,加入瓊脂,加熱煮沸1 分鍾,分裝,滅菌。
14、甘露醇鹽瓊脂培養基
胰酪腖 5.0g 氯化鈉 75.0g
動物組織胃蛋白酶水解物 5.0g 酚紅 25mg
牛肉浸出粉 1.0g 瓊脂 15.0g
D-甘露醇 10.0g 純化水 1000mL
除甘露醇、酚紅、瓊脂外,取上述成分,混合,微溫溶解,調節pH 值使滅菌後在25℃的pH 值為7.4±0.2,加熱並振搖,加入甘露醇、酚紅、瓊脂,煮沸1 分鍾,分裝,滅菌。
15、梭菌增菌培養基培養基
腖 10.0g 鹽酸半胱氨酸 0.5g
牛肉浸出粉 10.0g 乙酸鈉 3.0g
酵母浸出粉 3.0g 氯化鈉 5.0g
可溶性澱粉 1.0g 瓊脂 0.5g
葡萄糖 5.0g 純化水 1000mL
除葡萄糖外,取上述成分,混合,加熱煮沸使溶解,並不斷攪拌。如需要,調節pH 值使滅菌後在25℃的pH 值為6.8±0.2。加入葡萄糖,混勻,分裝,滅菌。
16、哥倫比亞瓊脂培養基
胰酪腖 10.0g 玉米澱粉 1.0g
肉胃蛋白酶消化物 5.0g 氯化鈉 5.0g
心胰酶消化物 3.0g 瓊脂 10.0~15.0g(依凝固力)
酵母浸出粉 5.0g 純化水 1000mL
除瓊脂外,取上述成分,混合,加熱煮沸使溶解,並不斷攪拌。如需要,調節pH 值使滅菌後在25℃的pH 值為7.3±0.2,加入瓊脂,加熱溶化,分裝,滅菌。如有必要,滅菌後,冷至45~50℃加入相當於20mg 慶大黴素的無菌硫酸慶大黴素,混勻,傾注平皿。
17. 念珠菌顯色培養基
腖 10.2g 瓊脂 15g
氫罌素 0.5g 滅菌水 1000ml
色素 22.0g
除瓊脂外,取上述成分,混合,微溫溶解,調節pH 值使滅菌後在25℃的pH 值為6.3±0.2。濾過,加入瓊脂,加熱煮沸,不斷攪拌至瓊脂完全溶解,傾注平皿。
說明:
1.微生物限度檢查法收載於《中國藥典》一、二、三部附錄中,內容基本一致。
2.本稿是2010 年版微生物限度檢查中“控製菌檢查、培養基準備”的內容修訂稿,參照ICH 協調案“非無菌產品微生物限度檢查:控製菌檢查法”進行修訂。
上一篇:無菌檢查法-2015版中國藥典

